23.1: Acidez relativa de los hidrógenos alfa
- Page ID
- 76786
Acidez de Hidrógenos Alfa
Los átomos de hidrógeno de alquilo unidos a un átomo de carbono en una posición a (alfa) relativa a un grupo carbonilo muestran una acidez inusual. Mientras que los valores de pK a para los enlaces alquilo C-H son típicamente del orden de 40-50, los valores de pK a para estos hidrógenos alfa son más del orden de 19-20. Esto se puede explicar más fácilmente por la estabilización por resonancia del carbanión producto, como se ilustra en el diagrama a continuación.
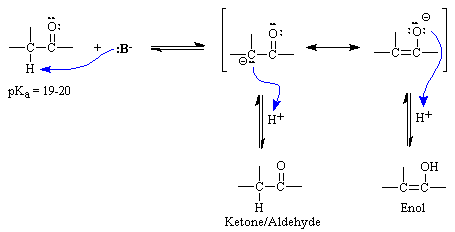
En presencia de una fuente de protones, el producto puede revertir a la cetona o aldehído de partida o puede formar un nuevo producto, el enol. La reacción de equilibrio entre la cetona o aldehído y la forma enol se conoce comúnmente como “tautomería ceto-enol”. La cetona o aldehído es generalmente fuertemente favorecida en esta reacción.
Debido a que los grupos carbonilo son sp 2 hibridados, el carbono y el oxígeno tienen orbitales p no hibridados que pueden solaparse para formar el\(\pi\) enlace C=O.
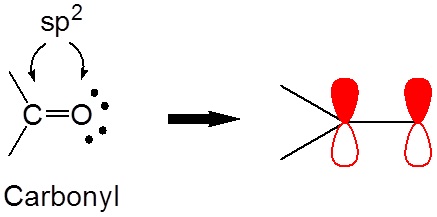
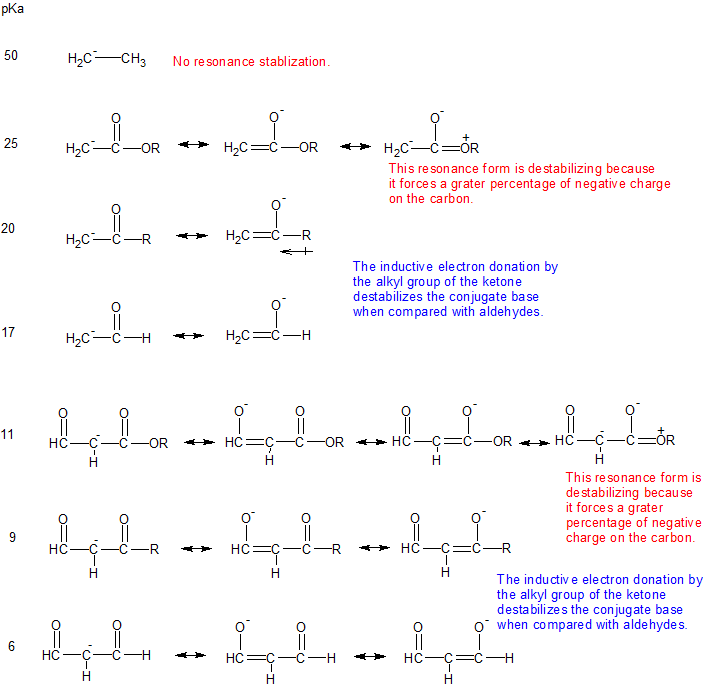
La presencia de estos orbitales p superpuestos da propiedades especiales a los\(\alpha\) hidrógenos (hidrógenos en carbonos adyacentes a los carbonilos). En particular,\(\alpha\) los hidrógenos son débilmente ácidos debido a que la base conjugada, llamada enolato, se estabiliza a través de la conjugación con\(\pi\) los orbitales del carbonilo. El efecto del carbonilo se observa al comparar el pK a para los\(\alpha\) hidrógenos de aldehídos (~16-18), cetonas (~19-21) y ésteres (~23-25) con el pK a de un alcano (~50).
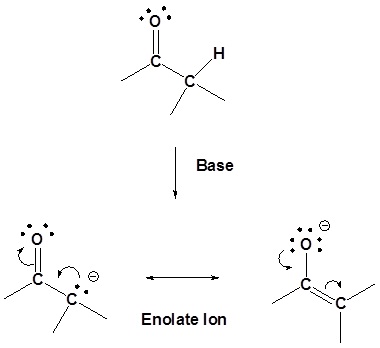
De las dos estructuras de resonancia del ion enolato, la que coloca la carga negativa sobre el oxígeno es la más estable. Esto se debe a que el cambio negativo se estabilizará mejor por la mayor electronegatividad del oxígeno.
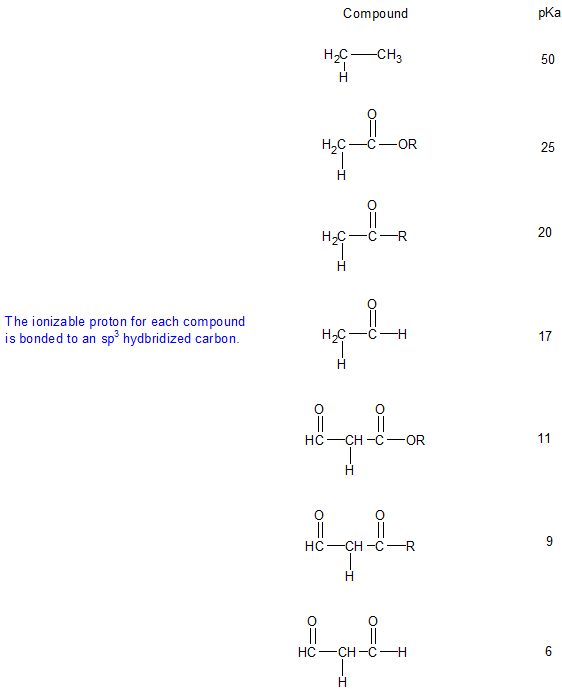
Acidez Relativa de Hidrógenos Alfa
La acidez de los hidrógenos alfa varía según el grupo funcional carbonilo como se muestra en la siguiente tabla. Evaluar la estabilidad de las bases conjugadas puede explicar las diferencias en la acidez relativa de los hidrógenos alfa.
Ejercicio
1. Dibuje la estructura de la línea de unión para cada compuesto en la tabla anterior incluyendo todas las formas de resonancia relevantes para explicar la acidez relativa.
- Contestar
-
1.
Colaboradores y Atribuciones
Colaboradores y Atribuciones
Prof. Steven Farmer (Sonoma State University)
Clarke Earley (Department of Chemistry, Kent State University Stark Campus)

