23.2: Enoles, Iones Enolados y Tautomerización
- Page ID
- 76798
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Introducción
Debido a la acidez de los hidrógenos alfa, los carbonilos experimentan tautomerismo ceto-enol. Los tautomeros son isómeros constitucionales rápidamente interconvertidos, generalmente se distinguen por una ubicación de enlace diferente para un átomo de hidrógeno lábil y un doble enlace ubicado de manera diferente. El equilibrio entre los tautomeros no solo es rápido en condiciones normales, sino que a menudo favorece fuertemente a uno de los isómeros (la acetona, por ejemplo, es 99.999% cetotautomero). Incluso en esos equilibrios unilaterales, la evidencia de la presencia del tautomero menor proviene del comportamiento químico del compuesto. Los equilibrios tautoméricos son catalizados por trazas de ácidos o bases que generalmente están presentes en la mayoría de las muestras químicas.

Mecanismo para la Formación de Enol y Enolato
En condiciones ácidas, se forma el tautomero enol. En condiciones básicas, se forma el tautomero enolado. Tanto el enol como el enolato son nucleófilos que pueden sufrir reacciones posteriores. A continuación se muestra el mecanismo para las condiciones de reacción tanto ácidas como básicas.
Condiciones ácidas
1) Protonación del Carbonil
2) Formación de enol
Condiciones básicas
1) Formación enolada
2) Protonación
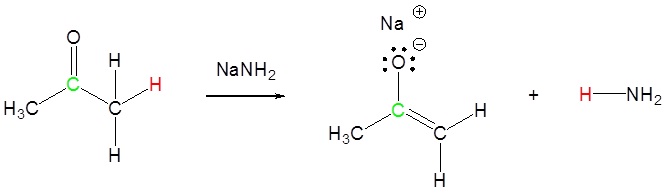
Para que las reacciones de los aniones enolatos sean útiles, estos intermedios deben generarse en alta concentración en ausencia de otros nucleófilos y bases fuertes. Las condiciones de base acuosa utilizadas para la condensación aldólica no son adecuadas debido a que los aniones enolato de compuestos carbonílicos simples se forman en muy baja concentración, y las bases de hidróxido o alcóxido inducen reacciones competitivas de S N 2 y E2 de haluros de alquilo. Es necesario, por lo tanto, lograr la conversión completa de los reactivos aldehídos o cetónicos en sus bases conjugadas enolato mediante tratamiento con una base muy fuerte (pK a > 25) en un disolvente no hidroxílico antes de que se agregue cualquier haluros de alquilo al sistema de reacción. Algunas bases que se han utilizado para la formación del anión enolato son: NaH (hidruro de sodio, pK a > 45), NaNH 2 (amida de sodio, pK a = 34) y LiN [CH (CH 3) 2] 2 (diisopropilamida de litio, LDA, pK a 36). Los disolventes de éter como el tetrahidrofurano (THF) se usan comúnmente para la formación de aniones enolato. Con la excepción de hidruro de sodio y amida de sodio, la mayoría de estas bases son solubles en THF. Ciertas otras bases fuertes, como alquil litio y reactivos de Grignard, no se pueden usar para elaborar aniones enolados porque se agregan rápida e irreversiblemente a grupos carbonilo. Sin embargo, estas bases muy fuertes son útiles en la fabricación de bases amida solubles. En la preparación de diisopropilamida de litio (LDA), por ejemplo, el único otro producto es el alcano butano gaseoso.

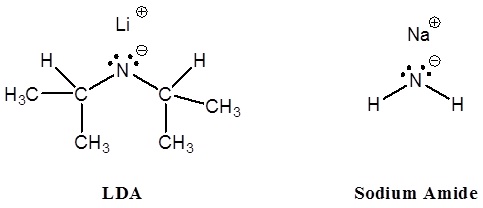
Debido a su solubilidad en THF, LDA es una base ampliamente utilizada para la formación de aniones enolatos. En esta aplicación, se produce un equivalente de diisopropilamina junto con el enolato de litio, pero esto normalmente no interfiere con las reacciones del enolato y se elimina fácilmente de los productos lavando con ácido acuoso. Aunque la reacción de los compuestos carbonílicos con hidruro de sodio es heterogénea y lenta, se forman enolatos de sodio con la pérdida de hidrógeno, y no se producen otros compuestos orgánicos.
La presencia de estos orbitales p superpuestos da propiedades especiales a los\(\alpha\) hidrógenos (hidrógenos en carbonos adyacentes a los carbonilos). En particular,\(\alpha\) los hidrógenos son débilmente ácidos porque la base conjugada, llamada enolato, se estabiliza a través de la conjugación con\(\pi\) los orbitales del carbonilo. El efecto del carbonilo se observa al comparar el pK a para los\(\alpha\) hidrógenos de aldehídos (~16-18), cetonas (~19-21) y ésteres (~23-25) con el pK a de un alcano (~50).
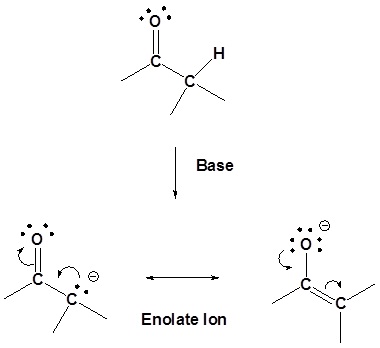
De las dos estructuras de resonancia del ion enolato, la que coloca la carga negativa sobre el oxígeno es la más estable. Esto se debe a que el cambio negativo se estabilizará mejor por la mayor electronegatividad del oxígeno.
| Grupo Funcional | Estructura | pK a |
|---|---|---|
| ácido carboxílico | H O— (C=O) R | 5 |
| nitro | RC H 2 —NO 2 | 9 |
| β-dicetona* | R (O=C) —C H 2 — (C=O) R | 9 |
| β-cetoéster * | R (O=C) —C H 2 — (C=O) O | 11 |
| β-diéster * | RO (O=C) —C H 2 — (C=O) O | 13 |
| amida | RN H — (C=O) R | 15 |
| alcohol | RC H 2 —OH | 16 |
| aldehído | RC H 2 — (C=O) H | 17 |
| cetona | RC H 2 — (C=O) R | 20 |
| tioéster | RC H 2 — (C=O) SR | 21 |
| éster | RC H 2 — (C=O) O | 25 |
| nitrilo | RC H 2 —C=N | 25 |
| sulfona | RC H 2 —SO 2 R | 25 |
| amida | RC H 2 — (C=O) N (CH 3) 2 | 30 |
| alcano | C H 3 —R | 50 |
* Tenga en cuenta que los grupos metileno que forman puentes entre dos grupos extractores de electrones son más ácidos que los protones alfa junto a un solo grupo carbonilo.
Ejemplos
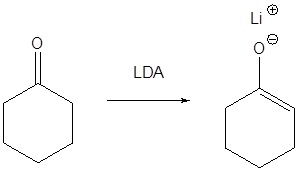
Si el enolato formado es estabilizado por más de un carbonilo es posible usar una base más débil como el etóxido de sodio.
NaOCh 2 CH 3 = Na + - OCH 2 CH 3 = NaoET

Debido a la acidez de los hidrógenos α, los carbonilos experimentan tautomerismo ceto-enol. Los tautomeros son isómeros constitucionales rápidamente interconvertidos, generalmente se distinguen por una ubicación de enlace diferente para un átomo de hidrógeno lábil y un doble enlace ubicado de manera diferente. El equilibrio entre los tautomeros no solo es rápido en condiciones normales, sino que a menudo favorece fuertemente a uno de los isómeros (la acetona, por ejemplo, es 99.999% cetotautomero). Incluso en esos equilibrios unilaterales, la evidencia de la presencia del tautomero menor proviene del comportamiento químico del compuesto. Los equilibrios tautoméricos son catalizados por trazas de ácidos o bases que generalmente están presentes en la mayoría de las muestras químicas.
Ejercicios
2. Dibuja las formas enol de las siguientes moléculas
- 4-metilciclohexanona
- Tioactetato de etilo
- Acetato de metilo
- Butanal
- Ácido propiónico
- 1-fenil-2-butanona
3. ¿Cuántos protones ácidos tiene cada una de las moléculas de la pregunta anterior? Etiquétalos.
4. Dibuja todas las formas de monoenol para la siguiente molécula. ¿Cuáles son los más estables? ¿Por qué?

- RESPUESTAS
-
2.
(a)

b)

c)

(d)

(e)

f)

3.
(a)

b)

c)

(d)

(e)

f)

4.

La capacidad de resonar estabiliza esta forma de enol.

Este enol no tiene formas de resonancia y por lo tanto es menos estable.
Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)

