25.6: Análisis de Aminoácidos de Péptidos
- Page ID
- 76156
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Objetivos
Después de completar esta sección, deberías poder describir, brevemente, cómo se puede determinar la identidad y las cantidades de cada residuo de aminoácido presente en un péptido de estructura desconocida.
Términos Clave
Concerciórate de que puedes definir, y usar en contexto, el término clave a continuación.
- Analizador de aminoácidos
Notas de estudio
No es necesario memorizar la reacción entre la ninhidrina y un α ‑aminoácido.
Cromatografía de intercambio iónico
Cuando se va a analizar una proteína, primero se calienta con ácido para hidrolizar todos los enlaces peptídicos. Cuando tal mezcla de aminoácidos se va a purificar y estimar cuantitativamente, la cromatografía de intercambio iónico es la técnica de elección. Ahora están disponibles analizadores de aminoácidos completamente automatizados, los cuales están equipados con una bomba de disolvente para suministrar los amortiguadores requeridos de manera programada. Hay una columna, rellena con resina Dowex 50 (Fig 26.5.1). Este soporte sólido está compuesto por perlas poliméricas. Químicamente hablando son polímeros que llevan grupos de ácido arilsulfónico. La resina de intercambio catiónico ayuda en la separación de aminoácidos. En una serie típica (Fig 26.5.2), el eluyente es un tampón. El valor de pH del tampón podría variarse como elución por etapas o como elución en gradiente. El cromatograma mostrado en la Fig 26.5.2 es un cromatograma realizado con técnica de elución en gradiente, utilizando ninhidrina como tratamiento post columna. El detector es un detector UV que escanea las longitudes de onda 570 nm y 440 nm.

Figura 26.5.1: Un catión Rasin como Dowex 50 es una perla polimérica que lleva grupos de ácido aril-sulfónico
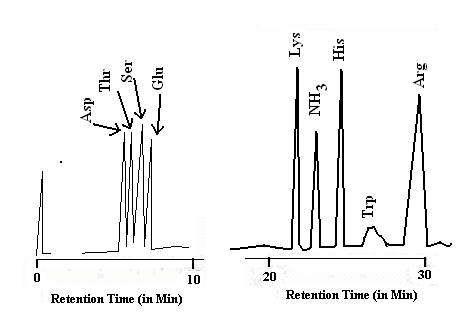
Fig 26.5.2: Algunos cromatogramas típicos de un analizador de aminoácidos
La reacción de la ninhidrina
Los alfa-aminoácidos muestran reactividad en sus sitios de ácido carboxílico y amina típicos de esos grupos funcionales. Además de estas reacciones comunes de aminas y ácidos carboxílicos, los alfa-aminoácidos comunes, excepto la prolina, experimentan una reacción única con el hidrato de tricetohidrindeno conocido como ninhidrina. Entre los productos de esta inusual reacción (que se muestra a la izquierda abajo) se encuentra un derivado imino de color púrpura, que proporciona como prueba de color útil para estos aminoácidos, la mayoría de los cuales son incoloros. Una aplicación común de la prueba de ninhidrina es la visualización de aminoácidos en cromatografía en papel. Como se muestra en el gráfico de la derecha, muestras de aminoácidos o mezclas de los mismos se aplican a lo largo de una línea cerca del fondo de una hoja de papel rectangular (la línea base). El borde inferior del papel se sumerge en un tampón acuoso, y este líquido sube lentamente hacia el borde superior. A medida que el frente de disolvente pasa por las manchas de muestra, los compuestos en cada muestra se transportan a una velocidad que es característica de su funcionalidad, tamaño e interacción con la matriz de celulosa del papel. Algunos compuestos se mueven rápidamente hacia arriba en el papel, mientras que otros apenas pueden moverse en absoluto. La relación de la distancia que un compuesto se mueve desde la línea base a la distancia del frente de disolvente desde la línea base se define como el factor de retardo (o retención) Rf. Diferentes aminoácidos suelen tener diferentes R f en condiciones adecuadas. En el ejemplo de la derecha, los tres compuestos de muestra (1, 2 y 3) tienen valores respectivos de R f de 0.54, 0.36 y 0.78.

Colaboradores y Atribuciones
Dr. Dietmar Kennepohl FCIC (Professor of Chemistry, Athabasca University)
Prof. Steven Farmer (Sonoma State University)
William Reusch, Professor Emeritus (Michigan State U.), Virtual Textbook of Organic Chemistry

