2.4: Grupos funcionales
- Page ID
- 76804
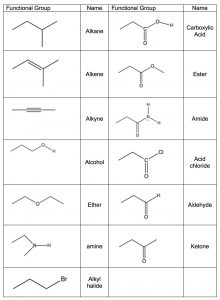
La idea de que un grupo carbonilo puede ser reconocido, independientemente de la estructura del resto de la molécula, es evidencia de una idea organizadora importante de la química orgánica, la de los grupos funcionales. Los grupos funcionales son grupos reconocibles de átomos dentro de una molécula más grande que tienen propiedades predecibles que nos permiten organizar y dar sentido a la química orgánica. En lugar de tener que mirar moléculas muy grandes como entidades enteras, (por ejemplo biomoléculas que tienen muchos miles a millones de átomos de carbono) podemos identificar grupos funcionales, y si sabemos cómo se comportan podemos predecir cómo se comportará la molécula. [14] En la tabla (\(\rightarrow\)) se muestra una lista de grupos funcionales comunes y es importante que con el tiempo aprendas a reconocer cada uno de ellos. Posteriormente, consideraremos cada uno de estos grupos con más detalle y discutiremos su química. Por el momento, es suficiente para poder reconocer a estos grupos y entender cómo utilizar la evidencia para la existencia de grupos funcionales que se pueden obtener de la espectroscopia IR. Las moléculas con grupos funcionales siempre dan lugar a patrones particulares de picos que corresponden a las vibraciones asociadas a ese grupo.
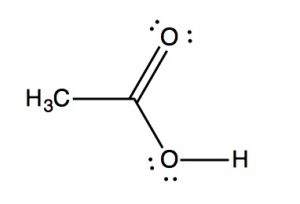
Los espectros IR pueden proporcionar evidencia de la presencia de muchos de estos grupos funcionales, aunque en la práctica los grupos más fácilmente detectados son los dobles enlaces, especialmente los\(\mathrm{N-H}\) grupos carbonilo (\(1600-1800 \mathrm{~cm}^{-1}\))\(\mathrm{OH}\) y y (arriba\(3000 \mathrm{~cm}^{-1}\)). Por ejemplo, el espectro de ácido acético (abajo) muestra dos absorciones muy fuertes (por encima de la región de la huella dactilar): una absorción muy amplia alrededor\(3000 \mathrm{~cm}^{-1}\), y una más fuerte, más estrecha alrededor\(1720 \mathrm{~cm}^{-1}\).
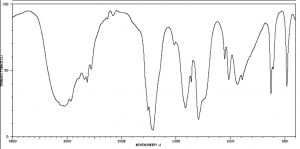
Espectro IR del ácido acético
El pico ancho corresponde al\(\mathrm{O-H}\) grupo en el ácido carboxílico. Es tan amplio porque este grupo participa en enlaces de hidrógeno de varios tipos y fortalezas, lo que significa que la energía requerida para promover este estiramiento de enlace varía con el grado de enlace de hidrógeno. El pico a\(1720\) corresponde al grupo carbonilo. Cabe señalar que también hay\(\mathrm{C-H}\) estiramientos alrededor\(3000\) que están ocultos por los\(\mathrm{OH}\) tramos fuertes. El mensaje para llevar a casa aquí es que la espectroscopia IR es buena para identificar grupos de átomos (grupos funcionales) dentro de una molécula más grande, pero no nos proporciona información sobre cómo los átomos en la molécula están realmente dispuestos y conectados. Para ello necesitamos recurrir a otro tipo de espectroscopía: la resonancia magnética nuclear.
Preguntas para responder
- ¿Qué factores predicen la fuerza de la absorción de IR?
- ¿Qué factores predicen la posición de la absorción de IR?
- Dibuja una estructura para un ácido carboxílico en solución en metanol y úsala para explicar por qué la absorción del\(\mathrm{O-H}\) enlace es tan amplia.
Espectroscopia de Resonancia Magnética Nuclear (RMN)
es una forma de espectroscopia basada en el hecho de que los núcleos atómicos se comportan como pequeñas cargas giratorias que generan un campo magnético. Al igual que con los electrones, los núcleos tienen una característica que llamamos “spin” que se cuantifica. [15] Los núcleos pueden tener espines que son enteros (\((1,2,3 \ldots)\)) or non-integral spins (\(\frac{1}{2}, \frac{3}{2}, \frac{5}{2} \ldots)\)), and some have no spin. Those nuclei with a non-integral-spin quantum number are said to be NMR active, and of these the two most relevant to NMR analyses of organic molecules are \(\mathrm{H-} 1\)y\(\mathrm{C-} 13\), que tienen números cuánticos de espín de\(\frac{1}{2}\). When materials that contain carbon or hydrogen are placed in a magnetic field their nuclei can assume either of two possible orientations with respect to the field: a low energy orientation in which the spin- associated nuclear magnet is aligned parallel to the field and a high energy orientation in which the nuclear magnet is aligned anti-parallel to (against) the field. A parallel nucleus can be flipped to the anti-parallel orientation by absorbing the appropriate amount of electromagnetic energy—which happens to be in the radio-wave range. From the pattern of energy absorbed, we can deduce the structure of the molecule being analyzed (see below)
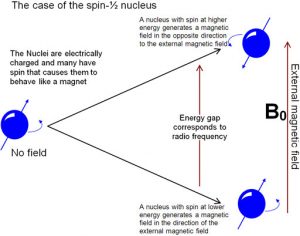
Las energías de radiación electromagnética que hacen que los núcleos giren un giro se denominan frecuencias de resonancia, (razón por la cual el método se denomina espectroscopia de resonancia magnética nuclear (RMN)). El mismo fenómeno está involucrado en la resonancia magnética (MRI), aunque la parte “nuclear” del nombre fue eliminada debido a la preocupación de que los pacientes podrían estar preocupados (innecesariamente) por la exposición a radiación dañina. Tanto la RMN como la MRI implican colocar el espécimen, ya sea una muestra química o un cuerpo humano, en un campo magnético muy fuerte, pero la energía utilizada para “voltear” el espín de los núcleos dentro de la muestra es relativamente baja, es decir, en el rango de radiofrecuencia. Estamos constantemente bombardeados por ondas de radio de baja energía pero su energía no es suficiente para ser absorbida por la mayoría de las moléculas, por lo que tienen poco efecto. [16] Es solo cuando se aplican campos magnéticos muy altos a una muestra (o cuerpo) que los estados de espín de los núcleos se dividen (en orientaciones que son paralelas y antiparalelas al campo) y observamos la absorción (o emisión) de estas ondas de radio de baja energía.
Un espectro de RMN (o una imagen de MRI para el caso) requiere que una muestra se coloque en un campo magnético fuerte. En los espectrómetros de RMN más antiguos, se cambia la intensidad del campo y se registran las frecuencias de resonancia. Las máquinas de RMN más nuevas (ahora casi todas) operan con una intensidad de campo magnético fijo; la muestra se irradia con radiación de radiofrecuencia (RF) en todas las frecuencias relevantes que excita todos los núcleos activos de RMN al estado de espín más energético. A medida que los núcleos se relajan, la máquina registra las energías de las emisiones, que luego se resuelven en distintas longitudes de onda utilizando una deconvolución basada en la transformada de Fourier.
La separación de los estados de espín (y por lo tanto la cantidad de energía requerida para voltearlos) depende de la intensidad del campo magnético externo. Por ejemplo, para un imán relativamente pequeño de 1.4 Tesla la RF utilizada es\(60 \mathrm{ MHz}\); at 7 Tesla the frequency is around \(300 \mathrm{ MHz}\).[17] The most modern instruments use very strong magnets, operating in the \(1000 \mathrm{ MHz}\) range. In practice stronger magnets provide better, more detailed spectra. Since different NMR instruments use different magnetic field strengths, they will also produce different RF absorption/emission peaks for same molecule. In order to make measurements from different NMR instruments comparable, the scale is set to show signals in terms of parts per million (\(\mathrm{ppm}\)) from a reference signal (see following section on chemical shift).


