5.5: Reacciones de alquinos
- Page ID
- 76957
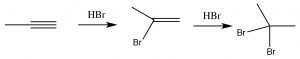
Como podrías predecir, los alquinos a menudo se comportan de manera similar a los alquenos. Los carbonos de triple enlace son una región rica en electrones de la molécula y esperamos que sufran adición electrófila, de manera similar a los alquenos. Entonces, por ejemplo, vemos la adición de Markovikov a través del triple enlace con\(\mathrm{HBr}\) (\(\rightarrow\)), la única diferencia\(\mathrm{HBr}\) es que si hay exceso, se agregarán dos, en lugar de uno, átomos de bromo; uno a cada uno de los carbonos originalmente con triple enlace. Otros reactivos se comportan de manera similar. Por ejemplo también\(\mathrm{Br}_{2}\) se sumará a través del triple enlace para dar primero el dibromo, y luego el compuesto tetrabromo.
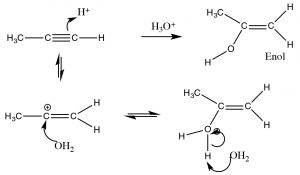
En contraste, cuando se agrega agua a través del triple enlace encontramos un resultado algo diferente. Si bien los pasos iniciales son los mismos: el electrófilo (\(\mathrm{H}^{+}\)) se suma al carbono menos sustituido, y el nucleófilo (\(\mathrm{H}_{2}\mathrm{O}\)) se suma al carbocatión que se produce. Esto produce una nueva funcionalidad llamada enol (Una combinación de alk ene y alcoh ol). El enol ahora sufre lo que se conoce como tautomerismo: el protón del resto alcohol se elimina (por el agua como base), y otro protón se recoge en el\(\mathrm{CH}_{2}\) carbono alqueno (\(\rightarrow\)). Como hemos visto muchas veces antes este tipo de reacción de protonación/desprotonación ocurre fácilmente sobre oxígeno o nitrógeno, pero esta es la primera vez que la vemos sobre un carbono; el tautomerismo ceto-enol es una parte importante de las reacciones de los grupos carbonilo.
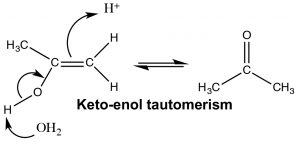
Las formas ceto-enol parecen ser compuestos diferentes y podríamos tener la tentación de clasificarlos como isómeros estructurales, pero no lo son. Las formas ceto-y enol siempre existen en equilibrio entre sí, y aunque usualmente escribimos la estructura con el grupo carbonilo (la forma ceto-cetónica), siempre hay una pequeña cantidad de la forma enol presente. La transición entre las formas ceto-y enol de las bases nucleotídicas inicialmente confundió a Watson y Crick en su modelización de la estructura del ADN. [7]
Reducción de alquinos:
La adición de hidrógeno (\(\mathrm{H}_{2}\)) a los alquinos se puede lograr de varias maneras. Es posible reducir completamente el alquino al alcano completamente saturado correspondiente a través de la adición de dos\(\mathrm{H}_{2}\) moléculas. De hecho, cuando se utilizan catalizadores como\(\mathrm{Pd}\) (paladio) o\(\mathrm{Pt}\) (platino) la reacción no se puede detener en la etapa intermedia de alqueno. Sin embargo, existen catalizadores especializados que permiten la hidrogenación parcial al alqueno. Uno de ellos se conoce como catalizador de Lindlar, que es un catalizador menos eficiente (envenenado). Como cabría esperar (por analogía con la reducción de alquenos), se forma el producto cis-hidrogenado (\(\downarrow\)).
![]()
También es posible reducir un alquino al producto trans, pero para ello tenemos que utilizar un método diferente; un método que implica la adición paso a paso de los componentes de la reducción. Las condiciones para esta reducción requieren una fuente de protones y una fuente separada de electrones. Por ejemplo, una solución de metal de sodio (una fuente de electrones) en amoníaco líquido (una fuente de protones) a baja temperatura (ya que el amoníaco hierve a\(-33^{\circ} \mathrm{C}\)), se puede utilizar para reducir un alquino, pero como la reacción avanza a través de una adición gradual (no concertada), el producto formado es el alqueno trans: el producto más estable (\(\rightarrow\)).
![]()
Acidez de Alquinos Terminales:
Una reacción específica de alquino implica la acidez de protones unidos a carbonos hibridados sp. El\(\mathrm{pK}_{\mathrm{a}\) de tales protones está alrededor\(25\), que es mucho menor que el de los alcanos (\(> 55\)) o alquenos (\(\sim 45\)). De hecho, los protones alquinos “terminales” pueden ser eliminados por bases fuertes como\(\mathrm{NH}_{2}-\) (el ion amida), ya que el\(\mathrm{pK}_{\mathrm{a}\) de\(\mathrm{NH}_{3}\) (amoníaco) es\(33\) (\(\downarrow\)).
![]()
La acidez de los protones alquinos terminales puede explicarse por la idea de que la carga negativa (el par solitario en el anión resultante) se localiza en un orbital híbrido sp. Cuanto más carácter “s” en la órbita híbrida, más cerca del núcleo. Dado que el orbital sp es más “s” que cualquiera\(\mathrm{sp}^{2}\) u\(\mathrm{sp}^{3}\) orbitales, entonces el electrón del anión de carbono se mantiene más cerca del núcleo y por lo tanto es más estable que si el carbono estuviera\(\mathrm{sp}^{2}\) o\(\mathrm{sp}^{3}\) hibridado. El efecto es similar a la explicación de la carga nuclear efectiva para las tendencias de electronegatividad en la tabla periódica (es decir, por qué el flúor es más electronegativo que el oxígeno). El anión alquino es muy útil porque ahora es un nucleófilo de carbono, y atacará especies de carbono electrófilas en una\(\mathrm{S}_{\mathrm{N} 2\) reacción. Este es el primer ejemplo que hemos visto de la formación de enlaces carbono-carbono (aunque veremos muchos más).
![]()


