5.4: Oxidación de Alquenos
- Page ID
- 76967
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Hay una variedad de reactivos que pueden resultar en la oxidación (es decir, la adición de oxígeno a ambos carbonos) de un alqueno. [3] Estas reacciones son sintéticamente útiles porque nos permiten colocar grupos funcionales en carbonos adyacentes y estos grupos pueden ser modificados posteriormente. Los reactivos utilizados en estas reacciones de transformación son altamente reactivos, y la mayoría incluyen especies en estados de oxidación altos, como permanganato (\(\mathrm{MnO}_{4}{ }^{-}\)) y/o tetroóxido de Osmio (\(\mathrm{OsO}_{4}\)), o contienen enlaces oxígeno-oxígeno inestables (por ejemplo, Ozono\(\mathrm{O}_{3}\)) o un peroxiácido (ver más abajo). El factor común en estos reactivos es que son capaces de agregar oxígeno de diversas maneras al\(\mathrm{C=C}\) enlace. Muchas de las reacciones resultantes son bastante complejas, y no profundizaremos en sus detalles mecanicistas salvo cuando sea necesario: por ejemplo, para explicar por qué se produce una estereoquímica particular.
Epoxidación:
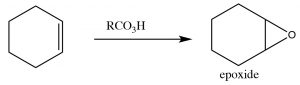
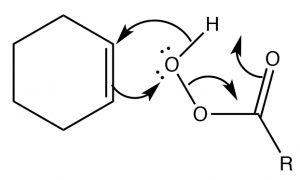
Los epóxidos (también conocidos como oxiranos) (\(\rightarrow\)) son éteres de anillo de tres miembros, y pueden formarse por la reacción de un alqueno con un perácido, es decir, un ácido carboxílico con un oxígeno extra (\(\leftarrow\)). La reacción se produce a través de un movimiento concertado (coordinado) de electrones. El resultado es que ambos carbonos en el doble enlace original terminan unidos al mismo\(\mathrm{O}\) átomo.
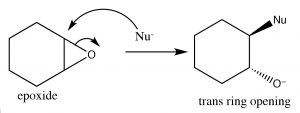
Recordemos que antes observamos las estabilidades relativas de los anillos, y encontramos que su estabilidad depende del tamaño del anillo y de la tensión torsional (eclipsante). Un anillo de carbono de tres miembros está muy tenso porque los ángulos de enlace están distorsionados lejos del\(109^{\circ}\) ángulo que requiere la\(\mathrm{sp}^{3}\) hibridación; además, todos los enlaces están eclipsados. El resultado es que los epóxidos son susceptibles al ataque nucleofílico en un anillo de carbono (\(\rightarrow\)). Una\(\mathrm{S}_{\mathrm{N}} 2\) reacción que procede a través del ataque desde la parte posterior del anillo, lo que lleva a la producción del producto trans. Tales reacciones de apertura de anillo se pueden lograr mediante una gama de nucleófilos, incluyendo agua. La reacción con agua da como resultado un trans diol. En general, bajo\(\mathrm{S}_{\mathrm{N}} 2\) condiciones la apertura del anillo también es estereoespecífica, es decir, el nucleófilo atacará al carbono menos obstaculizado (\(\downarrow\)).
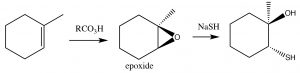
Los epóxidos tienden a ser reactivos y por esta razón pueden ser útiles como intermedios sintéticos. Dentro de los sistemas biológicos, su reactividad puede conducir a la modificación química del ADN, dando lugar a mutaciones (por esa razón, a muchos se les conoce como genóxicas o tóxicas para el genoma). Como defensa contra tales epóxidos, los organismos codifican enzimas conocidas como hidrolizados de epóxido. [4]
Cis-dioles:
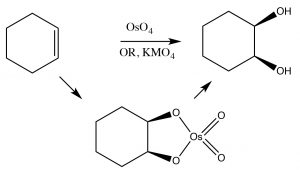
Los alquenos se pueden oxidar para producir cis-dioles usando un tipo diferente de reactivo que agrega átomos a través del doble enlace a través de un intermedio cíclico. Por ejemplo el permanganato (\(\mathrm{MnO}_{4}{ }^{-}\)) y el tetóxido de osmio (\(\mathrm{OsO}_{4}\)), los cuales contienen metales de transición en estados de alta oxidación, pueden lograr esta transformación (\(\rightarrow\)). Vale la pena señalar que controlando las condiciones de reacción, podemos optar por producir cis o trans dioles. A medida que avanzamos hacia una química orgánica más compleja veremos que la capacidad de elegir y predecir resultados es un componente importante de la química orgánica.
Ozonlisis:
Otro tipo de oxidación de doble enlace alqueno implica una reacción con el ozono (\(\mathrm{O}_{3}\)), el alótropo altamente reactivo del oxígeno. [5] El mecanismo es bastante complejo como se muestra a continuación (¡no es necesario memorizarlo!).
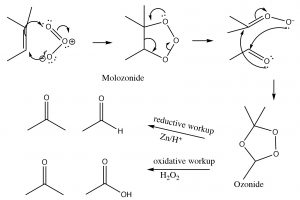
Típicamente, el ozono escinde el doble enlace y la reacción se trata con un agente reductor suave como el estaño (\(\mathrm{Sn}\)) [6], lo que lleva a la producción de los aldehídos o cetonas correspondientes (\(\downarrow\)).
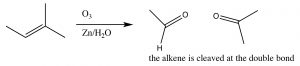
Como veremos más adelante, la reacción de ozonólisis puede ser útil para identificar la posición de un doble enlace dentro de una molécula, así como en la síntesis de aldehídos y cetonas.


