5: Alquenos y Alquinos
- Page ID
- 76939
Cuando un carbono está unido a uno o más átomos electronegativos, adquiere una carga positiva parcial y es electrófilo. Dichos carbonos electrófilos pueden sufrir reacciones de sustitución o eliminación nucleófilas, o ambas, dependiendo de las estructuras de las moléculas reaccionantes, la fuerza del nucleófilo y el tipo de disolvente en el que se produce la reacción. Ahora, pasamos a las reacciones que pueden sufrir las especies de carbono ricas en electrones.
Alquenos y alquinos.
Tanto los alquenos como los alquinos son “insaturados”, lo que significa que contienen dobles o triples enlaces carbono-carbono. El término insaturado proviene del hecho de que se pueden agregar más\(\mathrm{H}\) átomos a estas moléculas a través de los dobles o triples enlaces. Un alqueno simple contiene un par de carbonos unidos por un doble enlace; este doble enlace consiste en un enlace sigma y un enlace pi. El enlace sigma está formado por superposición de extremo a extremo de orbitales\(\mathrm{sp}^{2}\) híbridos, y el enlace pi por superposición de lado a lado de los orbitales p. Un enlace pi tiene dos lóbulos de densidad electrónica por encima y por debajo del plano de la molécula. Hay una serie de consecuencias en este arreglo:
- la región resultante de la molécula es plana (se dice que la molécula tiene geometría plana trigonal),
- la densidad de electrones entre los dos carbonos es alta porque hay cuatro electrones en esta región en lugar de dos, y
- la rotación alrededor de un doble enlace está restringida (en contraste con la rotación alrededor de un enlace simple).
La rotación alrededor de un doble enlace requiere romper el solapamiento del enlace pi y su posterior reforma. Al igual que con todos los fenómenos de ruptura de uniones, la etapa de ruptura de la unión requiere energía; de hecho, significativamente más energía de la que se requiere para provocar la rotación alrededor de un enlace simple donde no se produce ruptura de unión. Como veremos, estos tres factores tienen un marcado efecto sobre el comportamiento de los alquenos.
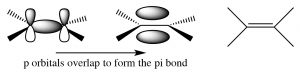
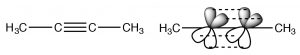
Los alquinos son compuestos que contienen enlaces triples. El triple enlace consiste en un enlace sigma formado a partir de la superposición de extremo a extremo de orbitales sp-híbridos y dos enlaces pi formados de lado a lado solapamiento. Los carbonos se\(\mathrm{sp}\) hibridan y la molécula es lineal en la región del triple enlace; nuevamente se restringe la rotación alrededor de un triple enlace, dos enlaces pi deben romperse para que ocurra (lo que requiere una entrada de energía). Esta disposición de unión da como resultado una\(\mathrm{C-C}\) región muy rica en electrones con el enlace sigma dentro de lo que parece un cilindro de densidad de electrones pi.
Nombrar Alquenos
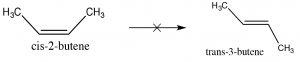
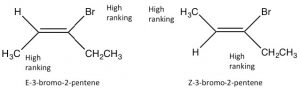
Dado que los alquenos han restringido la rotación alrededor del\(\mathrm{C=C}\) grupo, pueden existir como estereoisómeros. Por ejemplo, en el 2-buteno hay un metilo y un\(\mathrm{H}\) unido a cada uno de los carbonos de doble enlace (carbonos 2 y 3 de la molécula). Debido a que el\(\mathrm{C=C}\) grupo es plano,\(\mathrm{CH}_{3}\) los grupos pueden estar en los lados iguales (“cis”) u opuestos (“trans”) del doble enlace (\(\rightarrow\)); esta nomenclatura cis/trans es similar a la que usamos con los anillos de ciclohexano. A medida que los grupos unidos a cada carbono se vuelven más complejos, dicha nomenclatura rápidamente se vuelve confusa. Para hacer frente, recurrimos a otro esquema de nomenclatura establecido; en este caso, la convención Cahn-Ingold-Prelog que anteriormente usamos con centros quirales. Esto implica clasificar los grupos vinculados a cada carbono de doble enlace. Si los grupos altos están juntos (mismo lado), el nombre viene precedido por Z (de la palabra alemana para juntos: zusammen). Si están en lados opuestos, están etiquetados E (entgegen; lejos). Los isómeros E y Z son diastereoisómeros: tienen la misma conectividad pero ninguno puede superponerse a su imagen especular. En E-3-bromo-2-penteno, los\(\mathrm{CH}_{2} \mathrm{CH}_{3}\) grupos\(\mathrm{CH}_{3}\) y están más cerca entre sí que en Z-3-bromo-2-penteno; el resultado es que tienen diferentes propiedades físicas y químicas. Estas diferencias permiten separar los isómeros E y Z (y cis/trans ya que son solo un caso especial de E/Z) entre sí.
Estabilidad de alquenos:
Las reacciones de eliminación que producen alquenos tienden a favorecer al alqueno más sustituido como el producto principal. Las estabilidades relativas de varios alquenos se pueden determinar haciendo reaccionar el alqueno con hidrógeno y determinando el cambio de entalpía (\(\Delta \mathrm{H}\)).
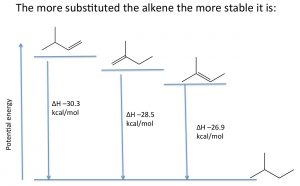
Por ejemplo, se muestra (\(\rightarrow\)), los tres alquenos diferentes producen el mismo producto, y por lo tanto las diferencias en la energía liberada deben surgir del hecho de que los alquenos iniciales tienen diferentes energías. Cuantos más grupos alquilo unidos al doble enlace, más estable (menos reactivo) es el alqueno, y por lo tanto se libera una menor cantidad de energía. La estabilidad molecular en alquenos se atribuye a las mismas causas que las estabilidades relativas de los carbocationes; los grupos alquilo estabilizan el enlace pi por hiperconjugación e inducción.


