6.1: (Brønsted) Acidez de alcoholes, tioles y aminas
- Page ID
- 76994
Recordemos que existen varios factores que pueden influir en la acidez de Brønsted. Estos incluyen: la fuerza del enlace entre el\(\mathrm{R}\) (\(\mathrm{C}\)) y el\(\mathrm{O}\),\(\mathrm{S}\), o\(\mathrm{N}\) (denotado por “\(\mathrm{Y}\)” abajo) y\(\mathrm{H}\); la polaridad del enlace; y la estabilidad del anión resultante (“\(\mathrm{Y}^{-}\)“). \[\mathrm{R}-\mathrm{Y}-\mathrm{H}+\mathrm{B}^{-} \rightarrow \mathrm{BH}+\mathrm{R}-\mathrm{Y}^{-}\]
Los alcoholes simples tienen acideces que son aproximadamente las mismas que el agua, con un\(\mathrm{pK}_{\mathrm{a}}\) de alrededor\(15-16\) (recuerda que el\(\mathrm{pK}_{\mathrm{a}}\) del agua es\(14\)). En comparación, las aminas son mucho menos ácidas, con\(\mathrm{pK}_{\mathrm{a}}\)'s alrededor\(33-36\). Entendemos esta diferencia con base en el hecho de que\(\mathrm{O}\) es más electronegativo que\(\mathrm{N}\), por lo tanto, el\(\mathrm{O-H}\) vínculo está más polarizado que el enlace, lo\(\mathrm{N-H}\) que hace que la carga positiva parcial en los bonos\(\mathrm{H}\) sea más grande\(\mathrm{O-H}\) que en\(\mathrm{N-H}\) los bonos. En disolventes polares, esto significa que el\(\mathrm{H}\) unido a un\(\mathrm{O}\) está mejor solvatado y el protón es más fácil de eliminar que un\(\mathrm{H}\) unido a un\(\mathrm{N}\). De manera similar, la carga negativa resultante sobre el anión es más estable sobre\(\mathrm{O}\) que sobre,\(\mathrm{N}\) porque la carga nuclear efectiva\(\mathrm{O}\) es mayor (que es la causa de su mayor electronegatividad, en comparación con\(\mathrm{N}\)). Por el contrario, los tioles son más ácidos que los alcoholes porque el\(\mathrm{S-H}\) enlace es más débil, el tamaño\(\mathrm{S}\) y los\(\mathrm{H}\) orbitales dan como resultado una superposición más pequeña y, por lo tanto, enlaces más débiles (al igual que\(\mathrm{HBr}\) es más ácido que\(\mathrm{HCl}\)) y el anión resultante es más estable porque el mayor tamaño de\(\mathrm{S}\) los resultados en la carga negativa que se distribuye sobre un volumen mayor.
Para desprotonar un alcohol simple, con un\(\mathrm{pK}_{\mathrm{a}}\) de alrededor\(15\), se requiere una base que forme un enlace con\(\mathrm{H}\) eso es que el enlace que se formaría con el alcóxido resultante (\(\mathrm{RO}^{-}\)); de lo contrario, la reacción ácido-base se revertiría. Por esta razón, no podemos usar una base como el hidróxido de sodio, porque su ácido conjugado\(\mathrm{H}_{2} \mathrm{O}\) tiene un\(\mathrm{pK}_{\mathrm{a}}\) de alrededor\(14\). Por lo tanto, aunque se produciría alguna desprotonación de alcohol en el agua, la posición de equilibrio estaría en algún lugar en el medio, de manera que ambos\({}^{-}\mathrm{OH}\) y\(\mathrm{RO}^{-}\) estarían presentes en la mezcla de reacción. Para desprotonar completamente un alcohol con un\(\mathrm{pK}_{\mathrm{a}}\) de alrededor\(15\), necesitaríamos usar una base más fuerte, como hidruro de sodio [1] (\(\mathrm{NaH}\)), o amida de sodio [2] (\(\mathrm{NaNH}_{2}\)).
![]()
Obsérvese que la reacción debe realizarse en un disolvente aprótico; en este caso se usa éter dietílico (de lo contrario el\(\mathrm{NaH}\) reaccionaría con el disolvente así como con el alcohol). Otro método común para desprotonar alcoholes es a través de una reacción redox, usando un metal del grupo uno, generalmente sodio.
![]()
Algunos alcoholes son mucho más ácidos; por ejemplo,\(-\mathrm{OH}\) los grupos unidos a un anillo aromático (que se llaman fenoles) suelen tener\(\mathrm{pK}_{\mathrm{a}}\) alrededor\(10\). Esta diferencia en\(\mathrm{pK}_{\mathrm{a}}\) debe estar en la naturaleza de la base conjugada (el anión), ya que el mismo\(\mathrm{O-H}\) enlace se rompe durante la transferencia de protones. En este caso, la base conjugada se estabiliza deslocalizando los electrones al anillo aromático por resonancia. Recordemos que cuanto más deslocalizada una carga (en este caso los electrones), más estable es el ion resultante.
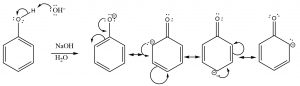
Los fenoles son más ácidos que los alcoholes típicos porque la base conjugada se estabiliza por resonancia
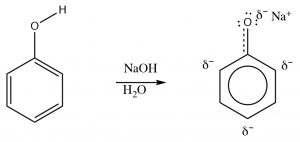
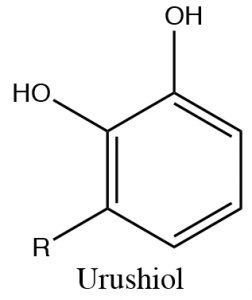
Los fenoles pueden desprotonarse\(\mathrm{NaOH}\) porque el anión fenolato es más estable que el hidróxido. Por lo tanto, los fenoles son solubles en soluciones acuosas de hidróxido de sodio. Esto también proporciona una forma de separar fenoles de otras sustancias orgánicas (no ácidas), ya que el fenol se puede regenerar simplemente agregando ácido. Una forma práctica de utilizar este fenómeno es eliminar las sustancias altamente alergénicas secretadas por las plantas de hiedra venenosa (o roble o zumaque). El alérgeno principal pertenece a una familia de difenoles llamada urushiol. La\(\mathrm{R}\) lata por cualquiera de una serie de hidrocarburos de cadena larga. Lavar la parte afectada con una solución básica (jabón por ejemplo) ayudará a solubilizar el urushiol y eliminarlo de la piel.
La acidez del alcohol también se puede incrementar por la extracción inductiva de electrones (debido a la presencia de átomos electronegativos unidos a través de enlaces sigma) tal como discutimos anteriormente en el caso de los ácidos carboxílicos: por ejemplo\(\mathrm{CF}_{3} \mathrm{OH}\) es más ácido que\(\mathrm{CH}_{3} \mathrm{OH}\).
También podríamos predecir los efectos relativos a las acideces de aminas y tioles en términos de resonancia y estabilización inductiva, pero, de hecho, la mayor parte de su química no está asociada con la acidez y no vamos a detenernos aquí en esta idea.


