6.4: Oxidación de Alcoholes
- Page ID
- 76985
Antes de discutir la oxidación de alcoholes, debe quedar claro a qué nos referimos con la “oxidación” y “reducción” de los compuestos de carbono. Recordemos que en discusiones anteriores se utilizó el término reducción para significar la adición de hidrógeno y oxidación para significar la adición de oxígeno, en lugar de calcular los cambios en los números de oxidación (disminución por reducción, aumento por oxidación). La razón es porque los números de oxidación en compuestos orgánicos pueden ser difíciles de calcular y aplicar [3]. En esta sección, consideramos cómo se pueden oxidar los alcoholes para dar aldehídos, cetonas o ácidos carboxílicos. En general, consideramos que un compuesto de carbono se oxida cuando aumenta el número de enlaces entre los átomos\(\mathrm{C}\) y electronegativos (a menudo, pero no siempre\(\mathrm{O}\)).
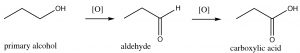
Por ejemplo, un alcohol primario puede ser oxidado (que denotaremos\(\mathrm{O}\) por el momento) a un aldehído; dependiendo del reactivo utilizado, la reacción puede proceder a través de una segunda etapa para producir el ácido carboxílico correspondiente. En cada paso, el nivel de oxidación del carbono va en aumento.
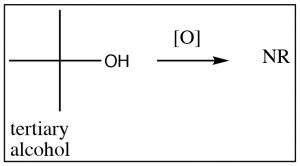
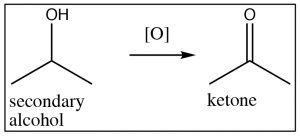
Partiendo de un alcohol secundario, el producto de una reacción de oxidación es la cetona correspondiente, pero los alcoholes terciarios no dan productos útiles y simplemente pueden conducir a la degradación (ruptura del\(\mathrm{C-C}\) enlace). Generalmente, no es posible oxidar un carbono secundario más allá del nivel de cetona sin romper los enlaces carbono-carbono, y de manera similar, los alcoholes terciarios no pueden oxidarse en circunstancias normales.
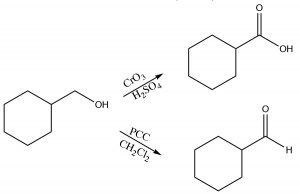
Los reactivos oxidantes típicos incluyen metales de transición en estados de alta oxidación (que es capaz de aceptar [enlace a]\(\mathrm{O}\) átomo). Por ejemplo, el cromo (VI) en forma de trióxido de cromo (\(\mathrm{CrO}_{3}\)) o dicromato de sodio (\(\mathrm{Na}_{2} \mathrm{Cr}_{2} \mathrm{O}_{7}\)), cuando está concentrado\(\mathrm{H}_{2} \mathrm{SO}_{4}\), son ambos poderosos agentes oxidantes y ambos oxidarán un alcohol primario a través de ambas etapas, es decir, hasta la forma de ácido carboxílico. El clorocromato de piridinio (\(\mathrm{PCC} \rightarrow\)) es un agente oxidante más suave que oxidará los alcoholes primarios, solo a través de la primera etapa, para producir un aldehído.
El mecanismo general de oxidación se muestra a continuación, nota que los electrones dejan el alcohol y terminan en el\(\mathrm{Cr}\), reduciendo su estado de oxidación de\(6\) a\(4\), y el carbono del alcohol termina oxidado.
Los alcoholes primarios se pueden oxidar selectivamente a aldehídos con PCC
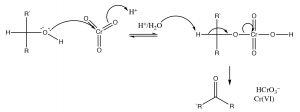
Un aspecto problemático de dichos reactivos oxidantes es que contienen altamente tóxicos y cancerígenos\(\mathrm{Cr}\) (VI) en una forma u otra. Dichos materiales oxidan una gama de biomoléculas como la vitamina C (ácido ascórbico) y algunos tioles (como el aminoácido cisteína). El cromo reducido también reacciona con los ácidos nucleicos y puede conducir a mutaciones, lo que puede llevar a la muerte celular y/o cáncer. Para evitar el uso de tales químicos tóxicos, ha habido un incremento en lo que ha llegado a conocerse como química verde [4]. Uno de los principios de la química verde es minimizar el uso de reactivos tóxicos (como los compuestos de cromo). [5]


