6.5: Oxidación de tioles
- Page ID
- 76986
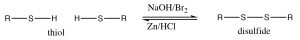
En los alcoholes, la oxidación generalmente ocurre en el carbono unido al oxígeno. En contraste, con los tioles el sitio de oxidación suele estar en el azufre. Por ejemplo, muchos agentes oxidantes (incluso oxígeno molecular en el aire) oxidan los tioles a disulfuros. La reacción inversa también se lleva a cabo fácilmente usando un agente reductor tal como\(\mathrm{Zn} / \mathrm{HCl}\). El enlace disulfuro es relativamente débil, es decir, requiere menos energía para romperse (aproximadamente la mitad de la fuerza de un\(\mathrm{C-H}\) enlace típico\(\mathrm{C-C}\) o). [6]
De hecho, los aminoácidos cisteína y diaminoácido cistina se interconvierten fácilmente en sistemas biológicos (generalmente a través del sistema de\(\mathrm{NADH} / \mathrm{NAD}\) oxidación/reducción; ver más abajo). Estos enlaces disulfuro entre restos de cisteína en polipéptidos y proteínas a menudo sirven para estabilizar la estructura 3D de las proteínas.

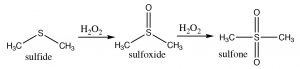
Los sulfuros (\(\mathrm{R-S-R}\)) también son susceptibles a la oxidación, lo que puede conducir a la formación de un sulfóxido, que puede oxidarse adicionalmente para formar una sulfona.