8.1: Reacciones de Bencenos Sustituidos - Reacción en la Posición Bencílica
- Page ID
- 76842
La posición próxima al anillo de benceno es especial porque especies reactivas como carbaniones, carbocationes o radicales en ese sitio pueden conjugarse (y por lo tanto estabilizarse) con el sistema de benceno pi. Por ejemplo, ya hemos visto que el fenol (\(\mathrm{C}_{6}\mathrm{H}_{5}\mathrm{OH}\),\(\mathrm{pK}_{\mathrm{a}} \sim 10\)) es mucho más ácido que un alcohol típico (\(\mathrm{pK}_{\mathrm{a}} \sim 16\)) porque la carga negativa puede estabilizarse en el anillo aromático. De manera similar, los haluros de bencilo (e.e.\(\mathrm{C}_{6}\mathrm{H}_{5}\mathrm{CH}_{2}\mathrm{Br}\)) experimentan sustitución nucleofílica bajo\(\mathrm{S}_{\mathrm{N}} 1\) condiciones, aunque estos compuestos parecen ser haluros primarios, se puede estabilizar un carbocatión próximo al anillo.
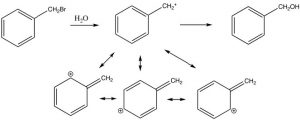
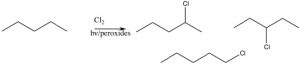
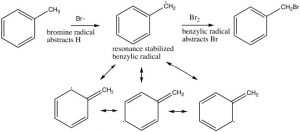
La posición próxima al anillo se llama posición bencílica, y es particularmente reactiva debido a la capacidad de estabilizar cualquier intermedio en el anillo aromático. Por ejemplo, es posible introducir selectivamente un bromo en la posición bencílica a través de una reacción en la que se generan radicales. Hemos dedicado poco tiempo a las reacciones de compuestos orgánicos con radicales [9], porque, en general, estas reacciones son muy difíciles de controlar. Por ejemplo, un alcano reaccionará con halógenos en presencia de luz o peróxidos (que inician la reacción formando un radical), pero la reacción no es sintéticamente útil y típicamente el halógeno puede terminar en todas las posiciones posibles.
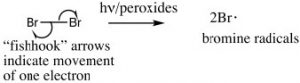
Sin embargo, podemos introducir selectivamente un átomo de bromo en una posición bencílica, debido a que el radical bencílico intermedio es más estable, y tendrá una menor energía de activación a la formación. La reacción comienza produciendo un radical bromo a partir\(\mathrm{Br}_{2}\) de romper el enlace con la luz para dar dos\(\mathrm{Br}\) radicales. El\(\mathrm{Br}\) radical abstrae (elimina) a\(\mathrm{H}\) de la posición bencílica para dar el radical bencílico estabilizado por resonancia que luego abstrae a\(\mathrm{Br}\) del bromo (\(\mathrm{Br}_{2}\)).
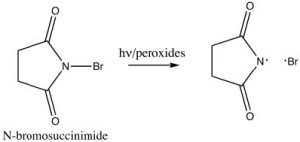
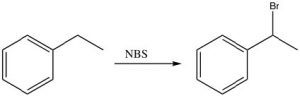
En la práctica, utilizamos una fuente de radicales bromo que es más fácil de manejar que el bromo elemental, la N-bromosuccinimida (NBS), que tiene un\(\mathrm{N-Br}\) enlace débil que se romperá homolíticamente (es decir, para dar dos radicales) en presencia de luz o peróxidos. El NBS reaccionará con alquilbencenos para introducir un bromo específicamente en la posición bencílica.
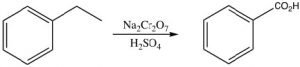
Otra reacción única de las posiciones bencílicas es que pueden ser oxidadas por reactivos tales como\(\mathrm{KMnO}_{4}\) para dar el ácido carboxílico correspondiente; cualquier otro carbono en la cadena lateral se elimina en el proceso.