8.2: Reacciones pericíclicas
- Page ID
- 76789
\[An image of Lewis acid base electrophile-nucleophile reactions.\]
Reacciones de Diels-Alder:
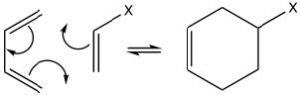
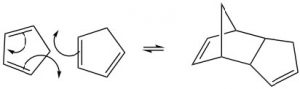
La más conocida de estas reacciones es una reacción de cicloadición conocida como reacción de Diels-Alder. Normalmente ocurre entre un dieno conjugado y otro alqueno conocido como el dienófilo. Esta reacción es muy útil en síntesis porque forma dos nuevos\(\mathrm{C-C}\) enlaces al mismo tiempo. También es estereoespecífico y regioespecífico. El dieno más simple que puede participar en un Diels-Alder es el butadieno. Típicamente, el butadieno tiende a existir en la conformación s-trans [10] más estable; sin embargo, hay una concentración de equilibrio de la conformación s-cis a través de la cual puede ocurrir la reacción. De hecho, el ciclopentadieno, en el que el dieno se fusiona permanentemente en la conformación s-trans, reacciona rápidamente consigo mismo (puede ser tanto dieno como dienófilo) en una reacción reversible.
El “dienófilo” puede ser un alqueno simple, pero la presencia de un grupo aceptor de electrones (como un grupo carbonilo) en el doble enlace mejora los rendimientos. Podemos imaginar que la reacción se desarrolla de manera concertada. Nuevamente, la reacción es reversible, y la reacción inversa se conoce como retro Diels-Alder. Podemos utilizar nuestro conocimiento de la termodinámica para predecir las condiciones más adecuadas para la reacción. Recordemos que el alcance de cualquier reacción puede predecirse a partir del cambio de energía libre de Gibbs\(\Delta \mathrm{G} = \Delta \mathrm{H} – T \Delta \mathrm{S}\). Dado que la reacción produce dos nuevos enlaces\(\mathrm{C-C}\) simples y un nuevo enlace\(\mathrm{C-C}\) pi al tiempo que rompe dos enlaces\(\mathrm{C-C}\) pi, podemos suponer que el cambio de entalpía para esta reacción es negativo (la formación de enlaces libera energía y la ruptura de enlaces usa energía). Por lo tanto, el\(\Delta \mathrm{H}\) término siempre es favorable. También podemos predecir el signo del cambio de entropía para el sistema; dado que estamos produciendo una molécula\(\Delta \mathrm{S}\) a partir de dos, esperaríamos ser negativos también. El término entropía es desfavorable. A partir de este análisis, podemos ver que la temperatura a la que se lleva a cabo la reacción es crucial. Las altas temperaturas favorecerían la reacción inversa. Por lo tanto, las reacciones de Diels-Alder se realizan típicamente a temperaturas bastante moderadas que están entre la temperatura ambiente y\(150^{\circ} \mathrm{C}\)).
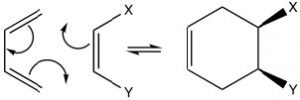
Las posibilidades de reacciones de Diels-Alder son bastante extensas y dado que esta es una reacción concertada, cualquier estereoquímica en los materiales de partida se conserva en los productos. Por ejemplo, si el dienófilo tiene estereoquímica cis o trans, ésta se conserva en el producto. El dienófilo cis da el producto cis (y viceversa para el trans).
Aquí se dan algunos ejemplos de reacciones de Diels-Alder.
Si bien podemos dibujar flechas mecanicistas para reacciones pericíclicas como Diels-Alder, se entienden mejor usando la teoría orbital molecular. En este tratamiento, podemos considerar que la reacción tiene lugar entre el orbital molecular ocupado más alto (HOMO) del dieno y el orbital molecular desocupado más bajo (LUMO) del dienófilo.
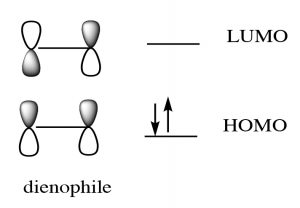
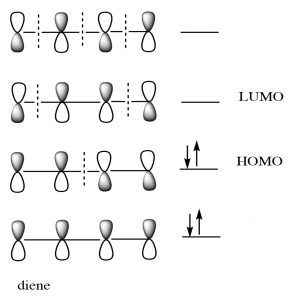
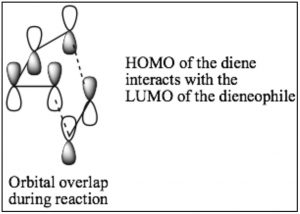
Para nuestros propósitos, este tratamiento es demasiado complejo, pero si vas a continuar con estudios de reacciones pericíclicas, la teoría MO será el enfoque que te permitirá predecir el resultado de muchas reacciones diferentes.
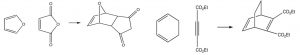
Si se forma un anillo fusionado durante la reacción, existen dos posibilidades para la orientación de los sustituyentes en el dieno como se muestra a continuación: exo y endo.
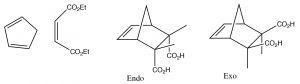
Debido a la posibilidad de una interacción estabilizante en la posición endo, (el sistema pi del ácido carboxílico puede interactuar con el sistema pi del dieno), generalmente se produce el producto endo.
Como se señaló anteriormente, existen otros tipos de reacciones pericíclicas. Todas las reacciones comunes que ocurren simplemente calentando los materiales de partida implican el movimiento cíclico de seis electrones. Los estados de transición para estas reacciones involucran orbitales moleculares que se extienden por todo el sistema; estos orbitales tienen una energía considerablemente menor de lo que cabría esperar. De alguna manera, esto es análogo a los 6 electrones pi de los sistemas aromáticos, que también se estabilizan en orbitales moleculares de menor energía.
Curiosamente, estas reacciones no ocurren de la misma manera si son iniciadas por radiación electromagnética (es decir, si brillamos luz sobre ellas en lugar de calentarlas). En este caso los electrones que participan en la reacción están en realidad en orbitales de mayor energía (el electrón absorbe un fotón y es promovido a un nivel de energía superior). La absorción de la luz conduce a un conjunto completamente diferente de reacciones y resultados, algo que se explora en cursos posteriores de química orgánica. Sin embargo, existe una reacción fotoquímicamente inducida particularmente interesante (y biológicamente relevante), a saber, la reacción de bases de timina adyacentes dentro de una molécula de ADN. Tras la absorción de un fotón UV, tales timinas adyacentes pueden sufrir una reacción electrocíclica que da como resultado la formación de dímeros.
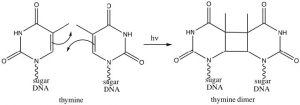
La presencia de un dímero de timina da como resultado cambios conformacionales en el ADN que, sin reparar, pueden conducir a mutaciones. Los dímeros de timina son reconocidos y reparados a través de dos mecanismos distintos de reparación celular. El daño no reparado puede provocar cáncer de piel (una variedad de carcinomas y melanomas).
Esta es una razón para limitar la exposición de la piel al sol.

