8.6: ¿Qué es la aromaticidad y cómo reconocemos los sistemas aromáticos?
- Page ID
- 76830
Para recapitular, el benceno es excepcionalmente estable y es relativamente difícil conseguir que reaccione, a pesar de la alta densidad de electrones en el anillo. Es significativamente más estable que el ciclohexadieno el cual está conjugado, pero solo contiene dos enlaces. Claramente hay algo especial en un sistema de anillos conjugados por encima y más allá de las simples propiedades de conjugación.
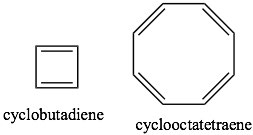
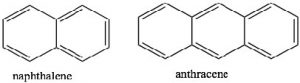
Si examinamos otros sistemas, podemos comenzar a encontrar los parámetros que rigen la propiedad de aromaticidad. Podemos comenzar por mirar algunos otros sistemas cíclicos conjugados. Muchos anillos fusionados de seis miembros (por ejemplo: naftaleno y antraceno) son aromáticos. Sin embargo, el ciclobutadieno y el ciclooctatetraeno no son aromáticos y tienen propiedades bastante diferentes.
Al investigar muchos sistemas conjugados cíclicos, ha sido posible identificar los factores que conducen a la aromaticidad.
Estos se conocen como Regla de Huckel: Los compuestos aromáticos son planos, cíclicos, conjugados, y tienen\(4 n + 2 \(\pi\) electrones en la nube de\(\pi\) electrones. El benceno es el compuesto aromático arquetípico: es plano (todos los carbonos\(\mathrm{sp}^{2}\) hibridados), cíclico (obviamente) conjugado (aparentes enlaces simples y dobles alternantes), y tiene\(6 \pi\) electrones (\(n=1\)). Si observamos el enlace dentro del benceno, vemos que\(\mathrm{p}\) los orbitales superpuestos forman un anillo de densidad de electrones pi por encima y por debajo del\(C-C\) marco sigma. De manera más general, los compuestos aromáticos deben ser planos, cíclicos y conjugados para que los orbitales p se superpongan para formar este anillo continuo de densidad electrónica. Entonces, ¿por qué los compuestos aromáticos tienen 4n+2 electrones π? La respuesta involucra la teoría orbital molecular.
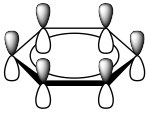

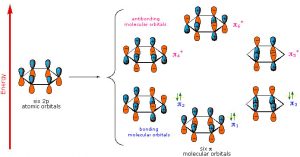
Como se señaló anteriormente, una consideración del número y tipo de orbitales atómicos que contribuyen al sistema de unión permite a la\(\mathrm{MO}\) teoría predecir los orbitales moleculares que abarcan toda la molécula. En benceno, tenemos seis orbitales\(\mathrm{p}\) atómicos y, por lo tanto, esperamos que se combinen para dar seis orbitales moleculares como se muestra aquí. Tenga en cuenta que hay tres enlaces y tres\(\mathrm{MO}\) antiadherentes y, como sólo hay seis electrones en el sistema, obtenemos un total de tres enlaces.
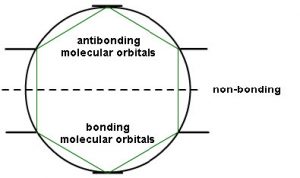
Este tipo de análisis se puede hacer para cualquier sistema conjugado cíclico. Si bien aquí es demasiado complejo para entrar en los fundamentos matemáticos, existe una manera relativamente sencilla de determinar las energías relativas del\(\mathrm{MO}\) s. El enfoque requiere que inscriba el sistema cíclico en un círculo, con una esquina del anillo en la parte inferior. Los lugares donde las esquinas se encuentran con el anillo son representan las energías relativas de la\(\mathrm{MO}\) s, como se muestra a continuación. Este arreglo es el origen de la\(4 n + 2\) regla como veremos.
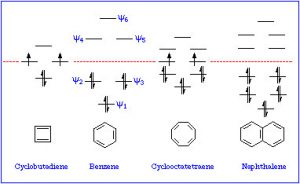
Entonces, por ejemplo, si consideramos el ciclobutadieno (que tiene\(4 n \pi\) electrones), vemos que hay 4\(\mathrm{MO}\) s y 4 electrones. Sin embargo, dos de esos electrones están en orbitales no estabilizados Y están desacoplados porque los orbitales son de la misma energía. Recuerda la regla de Hund: los electrones ocupan orbitales solos hasta que tienen que empezar a doblarse.
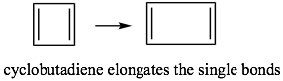
Esto significa que si el ciclobutadieno fuera aromático, sería altamente inestable porque contendría dos electrones desapareados, existiría como un dirradical. La presencia de electrones desapareados generalmente hace que los compuestos sean muy reactivos. De hecho, el ciclobutadieno no es aromático y en su lugar existe como dos dobles enlaces aislados alargando los enlaces simples. Aun así, sigue siendo inestable y no existe arriba\(-78^{\circ}\mathrm{C}\).
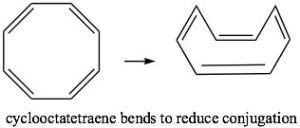
El ciclooctatetraeno también tiene\(4 n \pi\) electrones (donde\(n=2\)), y nuevamente vemos el problema es que hay un par de degenerados (misma energía)\(\mathrm{MO}\) s, donde se ubican los dos últimos electrones π. Nuevamente, esto es altamente desestabilizante y, para evitar esta configuración electrónica, el ciclooctatetraeno en realidad se dobla por lo que los dobles enlaces no se conjugan entre sí. El origen de la\(n+2\) regla, entonces, tiene que ver con la disposición de\(\mathrm{MO}\) s. Cualquier compuesto conjugado cíclico con\(4 n \pi\) electrones no podrá tomar un arreglo conjugado estable porque involucrará al dirradical altamente inestable.

