8.5: Aromaticidad
- Page ID
- 76841
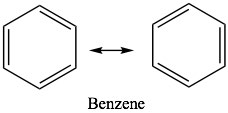
Después de considerar algunas de las propiedades de los sistemas conjugados, ahora pasamos a lo que podría ser lo último en sistemas conjugados, como lo ejemplifica el benceno\(\mathrm{C}_{6}\mathrm{H}_{6}\). Si bien muchas de las propiedades del benceno y sus derivados son similares en cierto modo a las de los sistemas conjugados de cadena abierta, existen diferencias importantes. El benceno tiene la propiedad conocida como aromaticidad y decimos que el benceno es aromático. En el lenguaje cotidiano, el término aromático implica que algo huele; generalmente en el buen sentido. Si bien el benceno sí tiene un olor bastante fuerte [7], en química, aromático ha llegado a significar un conjunto particular de propiedades que emergen de la estructura molecular de algunas moléculas. El benceno es el ejemplo más simple y común de un compuesto aromático. La estructura del benceno fue una especie de rompecabezas durante bastante tiempo; finalmente llegó a escribirse en forma de lo que ahora se llaman estructuras Kekulé en las que los enlaces dobles y simples parecen alternarse alrededor del anillo. Podemos escribir dos estructuras de resonancia equivalentes que contribuyen por igual a la estructura general de la molécula. Si bien estos modelos nos pueden servir bien a la hora de intentar averiguar qué están haciendo los electrones durante las reacciones, ninguno de ellos no es adecuado para representar la estructura real del benceno. En ocasiones, verá benceno escrito con un círculo en el medio (\(\beta\)) para indicar que, en realidad, no hay enlaces simples o dobles presentes; más bien, existe la misma densidad de electrones (1.5 enlaces) entre todos los carbonos.
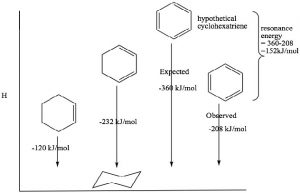
El benceno tiene algunas propiedades bastante notables que llevaron a los químicos a clasificarlo como miembro de un tipo de funcionalidad completamente diferente. Por ejemplo, el benceno es mucho más estable de lo que uno podría imaginar, incluso para un sistema conjugado. El calor de hidrogenación del benceno es\(-208 \mathrm{~kJ/mole}\), mientras que el\(\Delta \mathrm{H}\) de hidrogenación del doble enlace aislado en ciclohexeno es\(130 \mathrm{~kJ/mol}\). Podemos ver los efectos de la conjugación en 1,3-ciclo-hexadieno, que es\(\mathrm{232 \mathrm{~kJ/mol}\) (no 260 como podría esperarse si se conjugara). De igual manera, si el benceno no estuviera conjugado, esperaríamos que fuera un calor de hidrogenación\(3 \times 130 = 390 \mathrm{~kJ/mol}\). Por lo tanto, la diferencia entre la energía de hidrogenación esperada y la real debe deberse a la estabilización conferida por resonancia.
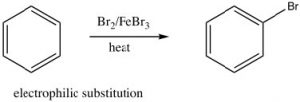
Esta estabilidad se denomina energía de resonancia y, en compuestos aromáticos como el benceno, tiene un efecto significativo sobre las propiedades de la sustancia y los tipos de reacciones en las que participa una molécula. Por ejemplo, el benceno no reacciona con los electrófilos de la misma manera que los alquenos aislados o incluso los alquenos conjugados de cadena abierta. Recordemos que la reactividad más común de los alquenos simples es la adición electrófila de E-Nu, donde E es un electrófilo y Nu es el nucleófilo, a través del doble enlace. Por el contrario, el benceno sufre sustitución electrófila; típicamente las condiciones de reacción requieren un catalizador y calentamiento extenso. En breve discutiremos el mecanismo de esta reacción, pero por ahora lo importante a tener en cuenta es que es difícil interrumpir el anillo aromático de los electrones y, cuando eso sucede, el anillo aromático se regenera.