8.12: Sustituciones nucleofílicas en sistemas aromáticos- Ampliar la gama de productos de sustitución potenciales
- Page ID
- 76788
Todas las reacciones en el anillo aromático hasta el momento han procedido por un solo mecanismo: la sustitución aromática electrófila. Hasta ahora, no hemos resuelto el problema de introducir sustituyentes que suelen reaccionar como nucleófilos en un anillo aromático. Hay varias formas de lograrlo y consideraremos tres de estos mecanismos.
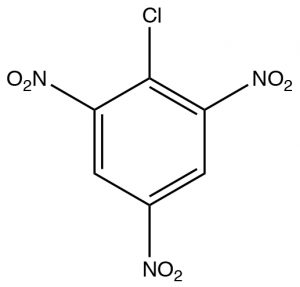
El primero, Sustitución Aromático Nucleofílica (\(\mathrm{SNAr}\)), es algo análogo a una\(\mathrm{S}_{\mathrm{N}} 2\) reacción. Ocurrirá si se cumplen dos condiciones: la primera es que debe haber un grupo lápida presente en el anillo, típicamente un haluro; la segunda es que la densidad de electrones del anillo debe reducirse. Esto se logra típicamente teniendo grupos aceptores de electrones tales como grupos nitro en el anillo. Podemos observar el efecto de agregar grupos aceptores de electrones observando los\(\mathrm{NMR}\) espectros de 2-cloro-1,3,5-trinitrobenceno. El único pico en el\(\mathrm{H-NMR}\) espectro es un\({}^{2}\mathrm{H}\) singlete en\(9.1 \mathrm{~ppm}\). Esto es considerablemente campo abajo\(7.3 \mathrm{~ppm}\) del benceno debido al efecto de los grupos nitro extractores de electrones. Este efecto explica por qué el anillo es susceptible al ataque nucleofílico.
La reacción procede por un ataque inicial de un nucleófilo como\(\mathrm{OH}\),\(\mathrm{OR}\), seguido de la pérdida del grupo de salida que lleva consigo el par de electrones.
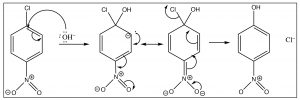
El anión intermedio puede ser estabilizado directamente por el grupo nitro, pero solo si ese grupo está en la posición orto o para. Si el grupo nitro es meta con respecto al grupo de salida la reacción no ocurrirá, porque tal estabilización no es posible (tratar de dibujar formas de resonancia para ello).
Un segundo mecanismo implica la eliminación\(\mathrm{HX}\) del anillo, seguido de una rápida adición de\(\mathrm{HY}\); puede considerarse análogo a las reacciones de eliminación y adición de alquenos y alquinos. El primer paso es la eliminación\(\mathrm{HX}\) del benceno, que produce una especie altamente reactiva y tensa que se llama benzino. Este intermedio experimenta una reacción muy rápida para agregar\(\mathrm{H}^{+}\) y a\(\mathrm{Y}^{–}\) través del doble enlace.
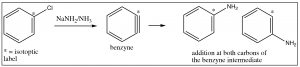
La evidencia de este mecanismo, más que\(\mathrm{SNAr}\), proviene de estudios de etiquetado de isótopos. Si el sitio original está marcado isotópicamente (por ejemplo\(\mathrm{C}-13\), con, el producto final tiene solo el 50% del nucleófilo en el sitio marcado y el 50% en el carbono adyacente. Si se tratara de una sustitución nucleofílica recta, toda la sustitución se llevaría a cabo en el carbono marcado.
Iones diazonio:
Otro enfoque que permite el acceso a múltiples productos implica la reacción de anilina (\(\mathrm{PhNH}_{2}\)) con el ion nitronio (producido en la mezcla de reacción) a lo que se conoce como un ion diazonio.
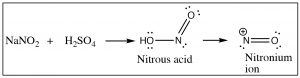
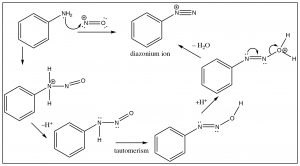
El ion diazonio es altamente inestable: debe prepararse a temperaturas alrededor\(0^{\circ}\mathrm{C}\); si la solución se calienta por encima de esta temperatura, se descompondrá perdiendo una molécula de nitrógeno (\(\mathrm{N}_{2}\)) para producir un carbocatión. Es esta descomposición la que puede ser capturada por una gama de nucleófilos. De alguna manera esta reacción es similar a una\(\mathrm{S}_{\mathrm{N}} 1\) reacción en la que se produce un carbocatión, que luego sufre un rápido ataque nucleofílico.
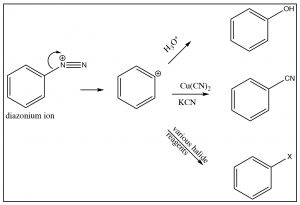
El carbocatión intermedio puede capturarse en presencia de un nucleófilo: por ejemplo, iones de agua, alcohol, haluro o cianuro. Obsérvese que todas estas reacciones típicamente requieren una temperatura elevada o la presencia de un catalizador de iones metálicos. Esto es para potenciar la velocidad de descomposición del ion diazonio, de manera que el carbocatión resultante pueda ser capturado por el nucleófilo. Es importante tener en cuenta que este carbocatión NO está estabilizado por resonancia (no se pueden dibujar formas de resonancia para estabilizar—pruébalo).
Reacciones de acoplamiento diazo:
Además de ser una forma de introducir algunos nucleófilos en anillos aromáticos, las sales de diazonio también experimentan lo que se conoce como reacción de acoplamiento. El ion diazonio en sí es susceptible al ataque nucleofílico si no se descompone demasiado rápidamente, generalmente por otro sistema aromático. Esta reacción ha sido utilizada para producir una amplia gama de tintes e indicadores.
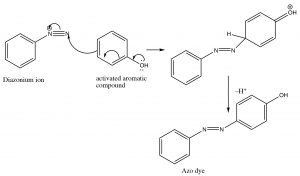
Estos compuestos azoicos tienen un cromóforo conjugado a largo plazo que típicamente resulta en la absorción de la luz visible, haciendo que los compuestos sean altamente coloreados (como resultado de la luz que se refleja y no se absorbe). La manipulación de grupos en cualquiera de los anillos de benceno puede extender la conjugación aún más. Alrededor del 50% de los tintes pertenecen a esta familia de compuestos.

