9: Un retorno al carbonilo
( \newcommand{\kernel}{\mathrm{null}\,}\)
Como hemos visto, los compuestos carbonílicos experimentan reacciones catalizadas tanto por ácidos como por bases que implican un ataque nucleófilo en el carbono carbonilo (o en el carbono beta de los carbonilos conjugados). Esta reacción, en sus múltiples formas, puede producir una impresionante gama de productos desde la formación de un éster a partir de un ácido hasta la producción de alcoholes a partir de carbonilos. Si bien estas reacciones pueden parecer superficialmente diferentes, si entiendes el mecanismo subyacente involucrado, es posible hacer predicciones plausibles para el resultado para literalmente miles de reacciones. Para este momento, deberías haber llegado a entender este tipo de procesos. Ahora, es el momento de reconsiderar los grupos carbonilo a la luz de que existe un conjunto completamente diferente de reacciones que implican la reactividad del carbono alfa de los grupos carbonilo. Los compuestos carbonílicos suelen existir en dos formas tautoméricas: las formas ceto-enol. La forma keto suele ser el tautómero principal y siempre hay algo de enol presente también.
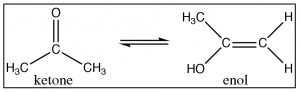
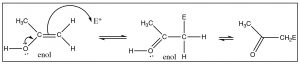
La estructura de la forma enol puede proporcionar pistas sobre su diferente reactividad, que es distinta de la de la forma keto. La forma enol consiste en un alcohol unido directamente a unC que está involucrado en un doble enlace. Como sabemos, los alquenos son ricos en electrones y tienden a sufrir un ataque electrófilo; la presencia de un−OH grupo unido hace que tal ataque electrófilo sea aún más probable. Al igual que un−OH grupo en un anillo aromático, elOH puede donar electrones a través de resonancia con el−C=C− y hacer que el enol sea más reactivo. Los grupos carbonilo pueden reaccionar, a través del pequeño porcentaje de la forma enol presente, para sufrir un ataque electrófilo en el carbono alfa.
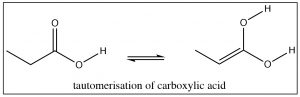
Ya hemos visto que los aldehídos y cetonas existen como tautómero ceto-enol, pero, de hecho, los ácidos carboxílicos, ésteres y otros derivados ácidos también tienen el potencial de existir en la forma enol correspondiente.
Otra implicación de la naturaleza alcohólica de un enol es que esperamos que sea ácido y de hecho lo es. La base conjugada del enol se llama ión enolato y está estabilizada por resonancia para que la carga negativa se deslocalice tanto en el oxígeno como en el carbono alfa.
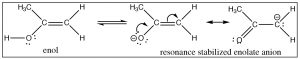
ElpKa de acetona es19 —algo más alto que un alcohol típico (pKa∼15). En la forma enolada, la mayor parte de la carga se asienta sobre el oxígeno más electronegativo, pero una proporción significativa de la carga negativa se asocia con el carbono alfa: el ion enolato es un carbanión estabilizado. El anión enolato a menudo se escribe en su forma carbanión porque esta es la forma que produce la mayor parte de la química interesante. El tratamiento de un compuesto carbonilo con una base, como un alcóxido, da como resultado la formación reversible de una pequeña cantidad del ion enolato (aunque el equilibrio se encuentra en el lado de la forma no protonada). De manera similar, muchos compuestos carbonílicos pueden desprotonarse para dar el anión enolato correspondiente. Por ejemplo, los ésteres pueden tratarse con una base para dar el anión enolato correspondiente.
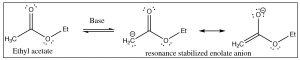
El acetatopKa de etilo tiene alrededor25 (menos ácido que la acetona:pKa19), pero aún así al alcance de muchas de las bases fuertes. Por ejemplo, la amida de sodio (NaNH2), la base conjugada del amoníaco (pKa33), es lo suficientemente fuerte como para desprotonar el éster. De hecho, normalmente usamos lo que se conoce como base impedida, como la di-isopropilamida de litio (LDA), que es similar a la amida sódica pero el nitrógeno tiene dos grupos isopropilo voluminosos unidos a ella. [1]
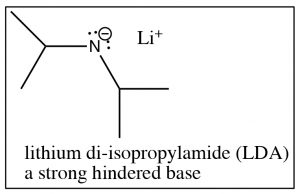
Dado queLDA es una base tan fuerte, el tratamiento de la mayoría de los compuestos carbonílicosLDA produce esencialmente el 100% del anión enolato correspondiente. No obstante, hay excepciones. Cualquier compuesto carbonílico que tenga un protón más ácido que elH asociado con el carbono alfa no sufrirá esta reacción. Por ejemplo, el tratamiento de ácidos carboxílicos con simplementeLDA dará como resultado la pérdida del protón ácido del grupo OH del ácido carboxílico.
La mayoría de los compuestos carbonílicos tienenpKa entre19 y25. Los compuestos que tienen grupos carbonilo que son beta entre sí (es decir, separados por un carbono intermedio), tienen significativamente menorespKa (alrededor9), debido a que el anión resultante puede estabilizarse en ambos oxígenos de carbonilo.
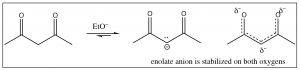
Se pueden desprotonar fácilmente por bases como etóxido de sodio o hidróxido de sodio.


