9.1: Reacciones de enoles y enolatos
- Page ID
- 77015
Las formas ceto-enol de los compuestos carbonílicos pueden sufrir reacciones completamente diferentes. La forma carbonilo (keto) sufre un ataque nucleófilo en el carbono carbonilo y la forma enol/enolato sufre un ataque electrófilo, generalmente en el carbono alfa (aunque también\(\mathrm{O}\) es reactiva). Por ejemplo, los aldehídos y cetonas pueden halogenarse en el carbono alfa solo por tratamiento con una solución del halógeno, ya sea con catálisis ácida o básica. El primer paso es la enolización, que produce el alqueno muy rico en electrones que ataca al bromo (al igual que el primer paso de adición a un alqueno normal). Este intermedio pierde entonces un protón para dar al compuesto halogenado y\(\mathrm{HBr}\).
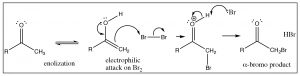
La reacción también se puede hacer en una base a través del enolato, pero en este caso la reacción es difícil de detener después de que se haya agregado un halógeno y, típicamente, todas las posiciones alfa terminarán bromadas. Tal reacción es análoga a la primera etapa de adición de halógenos a un alqueno, pero la segunda etapa implica la regeneración del carbonilo. Así como la adición nucleófila reversible al carbonilo típicamente produce el producto\(\mathrm{sp}^{2}\) hibridado, estas formas enol/enolato también terminan como sustituciones en lugar de adiciones.
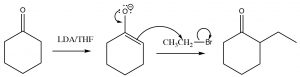
Una reacción de un carbono alfa que no tiene analogía en la química de alquenos implica su actuación como nucleófilo en una\(\mathrm{S}_{\mathrm{N}} 2\) reacción. La reacción se produce a través del anión enolato, que luego ataca cualquier haluro de alquilo apropiado a través de una\(\mathrm{S}_{\mathrm{N}} 2\) reacción.
Si la cetona que experimenta tal reacción tiene la posibilidad de formar dos enolatos diferentes, y por lo tanto producir dos productos de alfa alquilación diferentes, el enolato que tiene el doble enlace más sustituido es el más estable y se ve favorecido termodinámicamente. Típicamente, el enolato formado a partir del carbono menos impedido se forma más rápido (tiene la energía de activación más baja). Por lo tanto, es posible controlar el producto de tal reacción controlando cuidadosamente las condiciones de reacción. A temperaturas muy bajas, se forma el producto cinético, mientras que a temperaturas más altas se forma el producto termodinámico.


