1.1: Adhesión química
- Page ID
- 76414
Para resumir simplemente, un enlace químico es la fuerza atractiva que mantiene unidos átomos o iones. Dicha interacción atractiva conduce a un estado más estable para todo el sistema en comparación con los átomos individuales.
Los electrones de valencia juegan un papel fundamental en la unión química. En la configuración electrónica de un átomo, la capa más externa se llama la capa de valencia, y los electrones en la capa de valencia (capa más externa) se conocen como electrones de valencia. Tomemos el átomo de carbono por ejemplo: la configuración electrónica del carbono es 1s 2 2s 2 2p 2. La capa más externa es la segunda capa principal, por lo que hay 4 electrones de valencia en el carbono. Los electrones de valencia son los electrones que están más alejados del núcleo, y así experimentan la menor atracción del núcleo y por lo tanto son los más reactivos. Desempeñan el papel más importante en la unión química.
Ejercicios 1.1
Determinar el número de electrones de valencia para los siguientes elementos: B, N, O, Cl, Mg.
Respuestas a las preguntas de práctica Capítulo 1
Enlace iónico y enlace covalente
Hay dos tipos principales de enlaces químicos: enlaces iónicos y enlaces covalentes. Un enlace iónico es un enlace que resulta de la atracción electrostática (fuerza) entre iones de cargas opuestas. Los enlaces iónicos se aplican al compuesto iónico, como el cloruro de sodio (NaCl).
En compuestos iónicos simples, el elemento metálico pierde electrón (s) de valencia para formar el catión y el elemento no metálico gana electrón (s) para formar el anión. Con el número adecuado de electrones perdidos o ganados, tanto el catión como el anión logran una capa externa completa que contiene ocho electrones, como en los siguientes ejemplos de Na +, Ca 2, Cl — y O 2 — . Según la Teoría de Lewis, un átomo es más estable si su capa externa está llena o contiene ocho electrones. A esto también se le llama la regla del octeto.
Na (átomo) → Na + + e — Ca (átomo) → Ca 2+ + 2e —
Cl (átomo) + e — → Cl — O (átomo) + 2e — → O 2-
Un enlace covalente es un enlace formado a través del intercambio de pares de electrones entre los dos átomos de enlace. Los pares de electrones compartidos son mutuamente atraídos por los núcleos de ambos átomos. Al compartir los pares de electrones, ambos átomos también ganan una capa externa llena, o un octeto. Casi todos los enlaces involucrados en los compuestos orgánicos son enlaces covalentes.
El enlace covalente puede ser no polar o polar.
Para los enlaces covalentes formados entre dos átomos idénticos, los pares de electrones se comparten por igual entre los dos núcleos. La densidad de electrones se distribuye uniformemente a través del enlace, lo que hace que el enlace sea un enlace no polar. Los ejemplos incluyen todas las moléculas homonucleares, tales como H-H, Cl-Cl, O=O, N=N.
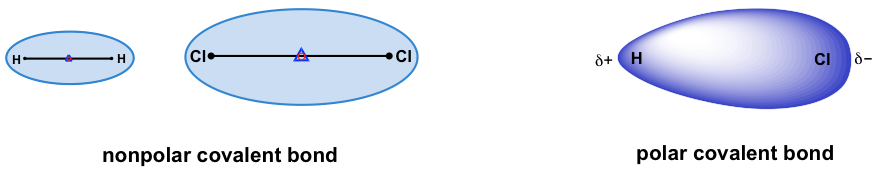
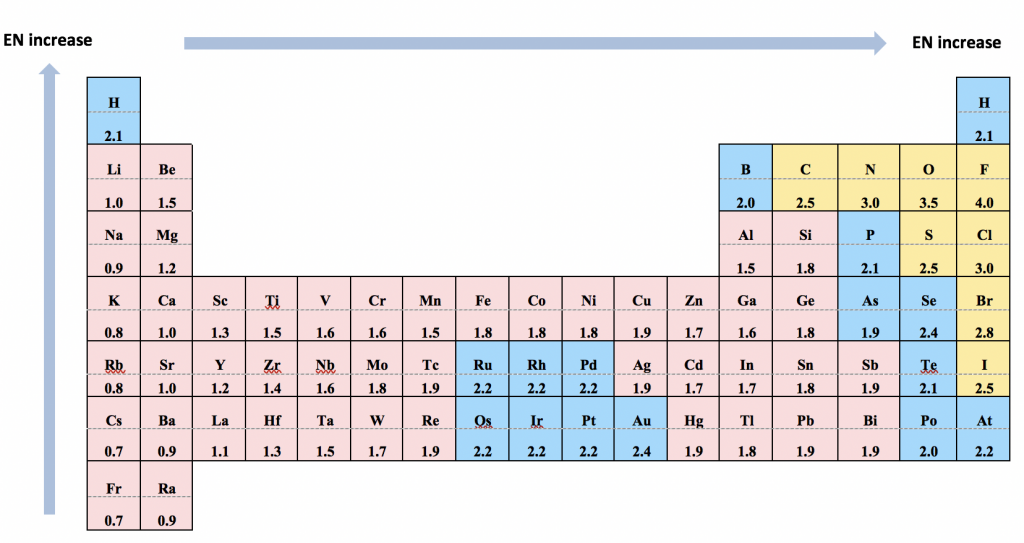
Para los enlaces heteronucleares (el enlace formado entre dos átomos diferentes), los pares de electrones no se comparten de manera uniforme, y el enlace es polar. Los pares de electrones son más atraídos por el átomo que tiene la capacidad más fuerte de tirar de los pares de electrones hacia sí mismo. Esta habilidad se mide con electronegatividad. Los valores relativos de electronegatividad (EN) se listan utilizando la escala ideada por Linus Pauling, como se resume en la siguiente tabla:
Notas sobre los valores de electronegatividad para fines de Química Orgánica:
- Es mucho más importante conocer la tendencia de la electronegatividad que memorizar los valores. La tendencia es que los valores de EN disminuyen a lo largo del grupo de arriba a abajo y aumentan a lo largo del periodo de izquierda a derecha (la tendencia funciona principalmente para elementos del Grupo Principal, no elementos de metales de transición).
- Es muy útil (aunque no obligatorio) conocer los valores EN de unos pocos elementos selectos: F (4.0, mayor), O (3.5), N (3.0), C (2.5) y H (2.1).
- La EN de C (2.5) y H (2.1) es bastante cercana, lo que hace que el enlace C-H (el enlace involucrado en todos los compuestos orgánicos) sea técnicamente no polar.
Con la introducción al concepto de electronegatividad, la polaridad del enlace se puede representar con la diferencia de electronegatividad entre los dos átomos de enlace, que se conoce como ΔEN. Para los enlaces no polares, ΔEN es igual a cero, y para los enlaces polares, ΔEN no es cero. Cuanto mayor sea ΔEN, más polar es el enlace.
Ejercicios 1.2
- Identificar los siguientes enlaces como “polares” o “no polares”: C-C, C-H, B-F, O-O, C=N
- Clasifique los siguientes enlaces en orden de aumentar la polaridad de unión: C—S, C—O, C—F (refiriéndose a la tendencia de EN, no es necesario usar los valores exactos EN).
Respuestas a las preguntas de práctica Capítulo 1
Debido a la diferencia de electronegatividad, el átomo con la EN más alta atrae a los pares de electrones compartidos con mayor fuerza, portando por lo tanto una carga ligeramente negativa (δ-). El otro átomo con una EN inferior lleva una carga ligeramente positiva (δ+). La dirección de la polaridad del enlace se puede indicar con una flecha, con la cabeza de la flecha apuntando al extremo negativo y una línea perpendicular corta cerca de la cola de la flecha marcando el extremo positivo. El siguiente ejemplo de una molécula H-Cl indica cómo mostrar la polaridad del enlace y las cargas parciales del enlace polar.