1.2: Estructura de Lewis
- Page ID
- 76399
La estructura de Lewis es una estructura que muestra la unión entre los átomos como líneas cortas (algunos libros usan pares de puntos), y los electrones de valencia no enlazantes como puntos.
1.2.1 Estructura de Lewis de moléculas diatómicas
Para conocer las estructuras de Lewis, comenzaremos con el símbolo de Lewis. El símbolo de Lewis es el símbolo químico de un elemento con electrones de valencia representados como puntos. Aquí se muestran los símbolos de Lewis de algunos elementos:
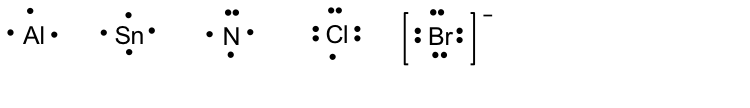
Para moléculas diatómicas simples, la combinación de los símbolos de Lewis de cada elemento le da su estructura de Lewis.
Ejemplo de H 2: (H solo necesita dos electrones; usualmente referido como un dueto. )
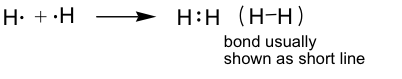
Ejemplo de F 2:
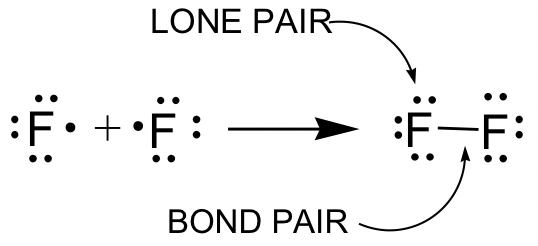
Términos utilizados en las estructuras de Lewis (ver ejemplo de F 2):
- Par de unión: El par de electrones de valencia involucrados en un enlace covalente. Los enlaces covalentes se dibujan como líneas cortas en este libro, y un enlace covalente significa un par de electrones de unión, es decir, 2 electrones. Pueden estar involucrados enlaces simples y enlaces múltiples (dobles o triples enlaces).
- Par solitario: Los pares de electrones de valencia no involucrados en el enlace covalente. Los electrones de pares solitarios también se pueden llamar pares de electrones no enlazantes.
Nota especial: Los electrones no enlazantes también pueden ser electrones desapareados (simples). Una especie con uno o más electrones desapareados (simples) se llama radical (radical libre). Más ejemplos de radicales con electrones simples estarán en la sección 1.2.5 y en el Capítulo 9.
Ejemplo de HCl:
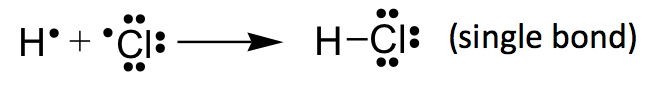
O 2 ejemplo:
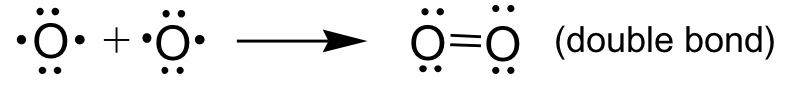
Ejercicios 1.3
Dibujar la estructura de Lewis de la molécula N 2.
Respuestas a las preguntas de práctica Capítulo 1
1.2.2 Estructuras Lewis de Moléculas Poliatómicas o Iones
Para moléculas e iones poliatómicos más complicados, las estructuras de Lewis no se pueden obtener simplemente peinando símbolos de Lewis. Se tiene que seguir un procedimiento específico con ciertos pasos. Es muy importante que sigas el siguiente procedimiento para obtener las estructuras de Lewis correctas para moléculas e iones poliatómicos.
Proceso de Dibujo de Estructura de Lewis para Moléculas Poliatómicas e Iones
1. Calcular el número total de electrones de valencia. Para los iones, asegúrese de que las cargas estén correctamente incluidas en el cálculo. Por ejemplo del catión NH 4 +:
el número total de electrones = 5 (átomo de N) + 4×1 (cuatro átomos de H) -1 (menos la carga para catión) = 8 electrones de valencia
2. Escriba una estructura esquelética plausible siguiendo los siguientes pasos:
a) Escribir símbolos atómicos para los átomos central y terminal.
- Los átomos de hidrógeno son siempre terminales
- Los átomos centrales son generalmente aquellos con la electronegatividad más baja
- Los átomos de carbono son siempre centrales
b) Conectar el átomo central con cada uno de los átomos terminales dibujando un enlace sencillo.
3. Por cada enlace sencillo, resta dos electrones del número total de electrones de valencia.
4. Usando los electrones de valencia restantes, completar primero los octetos de los átomos terminales, y luego completar tantos como sea posible para los átomos centrales.
5. Si has usado todos los electrones de valencia para completar octetos para todos los átomos, ya terminaste.
6. Si no, entonces complete los octetos de todos los átomos centrales moviendo pares solitarios de átomos terminales para formar múltiples enlaces.
7. Calcule las Cargas Formales en todos los átomos y etiquete las cargas formales distintas de cero en la estructura:
Carga formal sobre un átomo = No. de electrones de valencia en átomo libre—No. de electrones de par solitario —½ (No. de electrones de unión)
Fórmula 1.1
Ejemplos: Aquí tomaremos la molécula de CO 2 como ejemplo para explicar el procedimiento paso a paso:
1. Número total de electrones de valencia: 4 (átomo de C) + 2×6 (2 átomos de O) = 16
Siempre DOBLE COMPROBACIÓN: En la estructura correcta de Lewis, el número total de electrones involucrados (unión más electrones no enlazantes) debe ser igual a este número, ¡menos o más son ambos incorrectos!!
2. Escribe una estructura esquelética plausible:
Los átomos de carbono son siempre centrales, por lo que la estructura esquelética es: O — C — O
3. Hasta el momento se utilizan cuatro electrones, y quedan 16 — 4 = 12 electrones restantes.
4. Los 12 electrones restantes deben ser utilizados para completar el octeto para ambos átomos O terminales primero, y no quedan electrones después de eso.
![]()
¡Es muy importante tener en cuenta que los electrones restantes deben usarse para dar primero al octeto de átomos terminales!
5. El átomo de C central aún no obtiene octeto, debemos hacer el siguiente paso.
6. Al mover un par solitario de cada átomo O terminal, se obtiene la siguiente estructura.
esta es la estructura completa de Lewis del CO 2.
Para propósitos de estructura de Lewis, los pares solidos solo se pueden mover de átomos terminales al átomo central para formar múltiples enlaces, no al revés.
7. Verificación de cargos formales: todos los átomos tienen cargos formales iguales a 0 en esta estructura.
FC (C) = 4 -½× (4×2) = 0
FC (O) = 6 -4-½× (2×2) = 0
Dado que los dos átomos de oxígeno tienen el mismo enlace, un cálculo es suficiente para ambos átomos de oxígeno.
1.2.3 Directrices sobre Cargos Formales en Estructuras de Lewis
El propósito de las cargas formales es comparar la diferencia entre el número de electrones de valencia en el átomo libre y el número de electrones que el átomo “posee” cuando está unido. Cuanto menor es la diferencia, “más feliz” (más estable) es el átomo. El átomo posee todos los electrones de pares solitarios (no enlazantes) y la mitad de los electrones enlazantes (compartidos), razón por la cual la fórmula está en la forma dada en la Fórmula 1.1.
Las cargas formales pueden ser utilizadas como pautas para determinar la plausibilidad de las estructuras de Lewis comparando la estabilidad de las estructuras de resonancia no equivalentes, lo que es particularmente importante para las especies orgánicas. Las reglas sobre cargos formales son:
- La suma de las cargas formales debe ser igual a la carga total sobre la molécula o ión.
- Los cargos formales deben ser lo más pequeños posible (comparando el valor absoluto de los cargos formales para tales fines).
- “-” FC suele aparecer en los átomos más electronegativos (con la mayor capacidad de tirar de los electrones compartidos; este átomo está “ganando” electrones en el intercambio).
- “+” FC suele aparecer en los átomos menos electronegativos (con la capacidad más débil de tirar de los electrones compartidos; este átomo está “perdiendo” electrones en la compartición).
- Las estructuras que tienen cargas formales del mismo signo en átomos adyacentes son poco probables.
Existe una forma derivada para calcular la carga formal: dado que cada enlace contiene 2 electrones, la mitad de los electrones de unión simplemente equivale al número de enlaces. Entonces, el cargo formal también se puede calcular con base en la versión derivada de la fórmula:
Carga Formal sobre un átomo = No. de electrones de valencia en el átomo libre—No. de electrones de par solitario — No. de enlaces covalentes alrededor del átomo Fórmula 1.2
Los dobles enlaces cuentan como 2 y los enlaces triples cuentan como 3 en la Fórmula 1.2. Tanto la Fórmula 1.1 como la 1.2 funcionan para contar el cargo formal; puedes elegir cualquiera para tu comodidad. Si bien casi todos los demás libros de texto muestran la Fórmula 1.1 como la vía oficial, la Fórmula 1.2 es más fácil de usar y puede considerarse como la práctica basada en la experiencia.
Ejercicios 1.4
¿Por qué la siguiente estructura no es la mejor manera de mostrar la estructura Lewis del CO 2?
![]()
Respuestas a las preguntas de práctica Capítulo 1
1.2.4 Kekulé Structures vs Lewis Structures
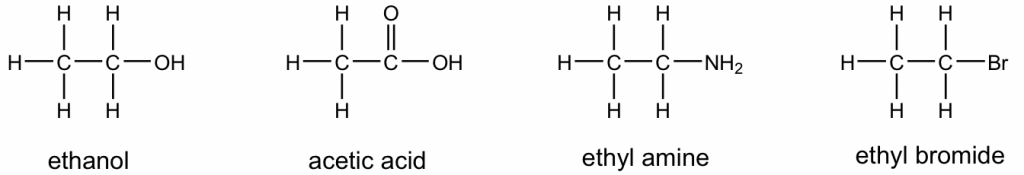
La estructura completa de Lewis siempre tiene que incluir todos los electrones de unión y electrones de pares solitarios. Sin embargo, las especies orgánicas generalmente se muestran como estructuras KeKulé (más discusión será en el Capítulo 2) con todos los electrones de pares solitarios completamente omitidos (con excepciones a los pares solitarios que se muestran para resaltar propiedades especiales). Por lo tanto, al ver las estructuras de Kekulé, es muy útil tener en cuenta que los átomos distintos de C y H deben tener cierto número de pares solitarios. Ejemplos de estructuras Kekulé de algunos compuestos se dan aquí:
1.2.5 Excepciones a la regla del octeto en la estructura de Lewis
Hasta el momento siempre hemos estado aplicando la regla del octeto en las estructuras de Lewis, sin embargo hay algunos casos en los que la regla no se aplica. Por ejemplo, H solo necesita 2 electrones. Aquí veremos algunos otros casos donde la regla del octeto se ve comprometida.
- Número impar de electrones
Si el número total de electrones de valencia es un número impar, la regla del octeto no se puede aplicar a todos los átomos de la especie. Los ejemplos podrían incluir NO (monóxido de nitrógeno u óxido nítrico), NO 2 (dióxido de nitrógeno) y radicales alquilo.??
NO molécula: Aunque el NO es una molécula diatómica, es posible dibujar la estructura de Lewis siguiendo el procedimiento. Dependiendo de qué átomo se le dé el octeto primero en el Paso 4, puede obtener dos estructuras posibles. Al aplicar la pauta de carga formal, podemos decidir que la primera estructura es la mejor opción con cero cargos formales.
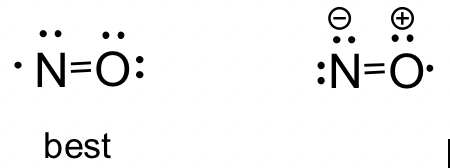
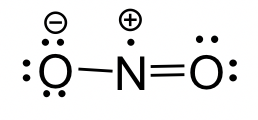
Molécula NO 2: A continuación se muestra la estructura de Lewis de la molécula de NO 2.
Para las moléculas anteriores, todas contienen electrones desapareados (simples). La especie neutra que contiene un electrón desapareado se llama radical (o radical libre). Cuando el átomo de carbono de un grupo alquilo tiene un electrón desapareado, la especie es el radical alquilo.
Radicales alquilo: El ejemplo más simple de radical alquilo es •CH 3, con el número total de electrones de valencia como 7. La estructura es:
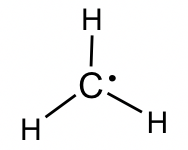
En el Capítulo 9 se incluirán más discusiones sobre las propiedades y reacciones de los radicales.
- Octeto incompleto
Un octeto incompleto significa que el átomo tiene menos de 8 electrones involucrados. Esto podría deberse a que el número total de electrones de valencia es inferior a 8, o debido a preocupaciones formales de carga.
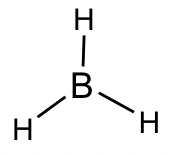
Molécula BH 3: El número total de electrones de valencia es 6, por lo que el átomo de boro central no obtiene un octeto.
Molécula BF 3: Aunque todos los átomos tienen la posibilidad de obtener octetos en la estructura de BF 3, la estructura real de BF 3 mantiene el octeto incompleto. La aplicación de la guía FC explica por qué la primera estructura es la mejor opción. Ejemplos similares incluyen BeF 2, AlCl 3.
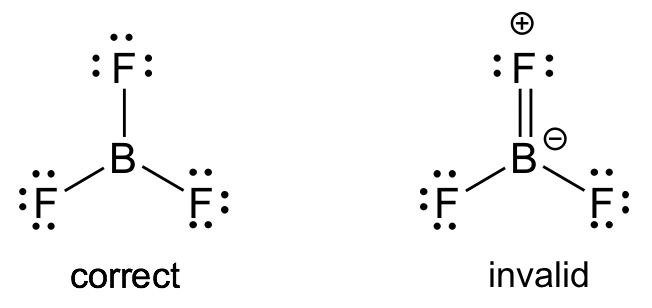
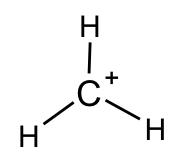
CH 3 +: Este es otro intermedio reactivo en las reacciones orgánicas (más discusiones en el Capítulo 8). Los cálculos de FC indican que la carga “+” se encuentra en el átomo de C, por lo que dicha especie también se llama carbocatión. El carbono tiene un octeto incompleto.
- Concha de valencia expandida
Para los elementos en el Período 3 o superior, pueden tener más de 8 electrones si eso ayuda a bajar las cargas formales. Los ejemplos comunes involucran a las especies con P, S o Cl, etc. como átomos centrales. A veces son necesarios múltiples dobles enlaces para minimizar la carga formal del átomo central. La estructura del anión fosfato, PO 4 3-, se da aquí como ejemplo.
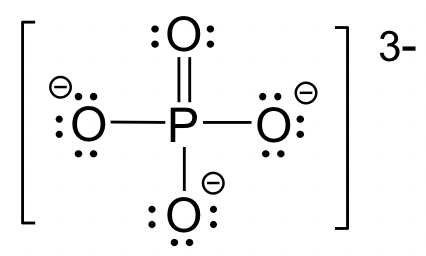
Claves para llevar
Para los elementos en el segundo periodo, C, N, O, F y Ne, el número máximo de electrones involucrados en la estructura de Lewis es de ocho!!!


