1.7: Respuestas a las preguntas de práctica Capítulo 1
- Page ID
- 76406
7
Respuestas a las preguntas de práctica Capítulo 1
Xin Liu
1.1 Número de electrones de valencia:
B: 3 electrones de valencia
N: 5 electrones de valencia
O: 6 electrones de valencia
Cl: 7 electrones de valencia
Mg: 2 electrones de valencia
1.2
- Identificar el siguiente enlace es “polar” o “no polar”?
C-C: no polar C-H: no polar (electronegatividad muy cercana para C y H)
B-F: polar. O-O: no polar C=N: polar
- Clasifique los siguientes enlaces en el orden de creciente polaridad de unión: C—S, C—O, C—F (refiriéndose a la tendencia de EN, sin necesidad de usar los valores exactos EN).
polaridad de unión: C—S < C—O < C—F
1.3 Dibujar la estructura de Lewis de la molécula N 2:![]()
1.4 ¿Por qué seguir la estructura no es la mejor manera de mostrar la estructura Lewis del CO 2?
![]()
Porque los cargos formales no se minimizan en la estructura anterior. Los cargos formales en la mejor estructura Lewis del CO 2 son todos cero, y la mejor estructura Lewis del CO 2 se muestra aquí:
![]()
1.5 Dibujar todas las estructuras de resonancia equivalentes para las siguientes especies. Incluir cualquier cargo formal distinto de cero en las estructuras.
- O 3 molécula
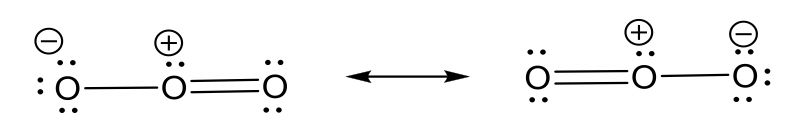
- anión nitrato NO 3 —
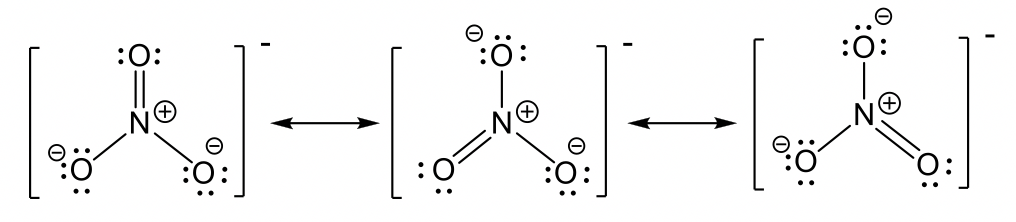
- anión clorato ClO 3 —
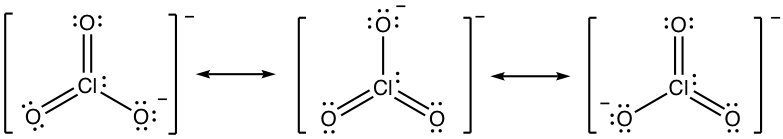
1.6 Dibujar todas las estructuras de resonancia para anión azida, N 3 —, e indicar la más estable.
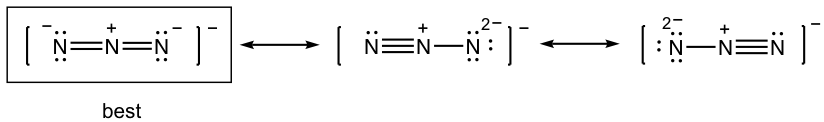
1.7 Dibujar nueva estructura de resonancia y comparar la estabilidad relativa, mostrar flechas en la estructura original.
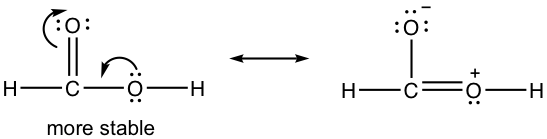
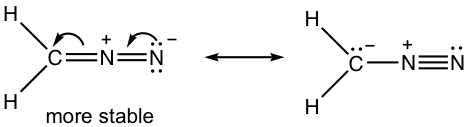
1.8
- ¿Cuál es la hibridación del átomo de oxígeno en la molécula H 2 O?

- ¿Cuál es la hibridación del átomo de xenón en la molécula xEF 4, y cuál es la forma de toda la molécula?



