1.6: Teoría de Enlace de Valencia e Hibridación
- Page ID
- 76407
1.6.1 Teoría de los bonos de valencia
Hemos hablado de cómo se forman los enlaces covalentes a través del intercambio de un par de electrones; aquí aplicaremos la teoría de los enlaces de valencia para explicar con más detalle cómo ocurre el intercambio. La teoría del enlace de valencia describe el enlace covalente formado a partir del solapamiento de dos orbitales atómicos medio llenos en diferentes átomos.
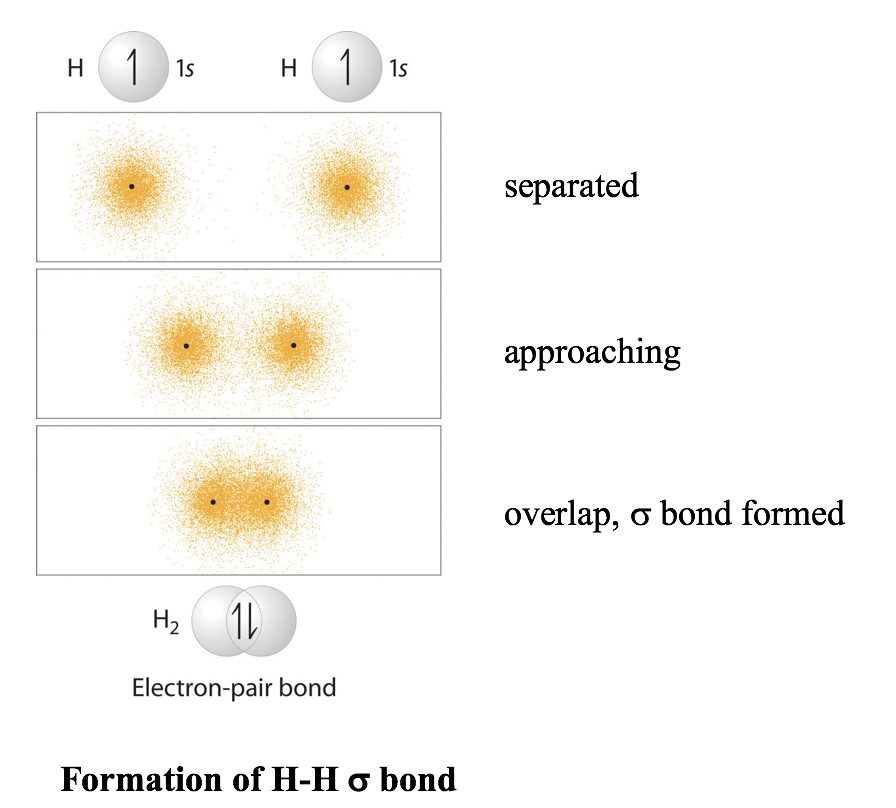
Empecemos con la molécula simple H 2. La configuración de electrones atómicos de un átomo de hidrógeno es 1s 1, lo que significa que hay un electrón (que también es el electrón de valencia) en el orbital 1s en forma de esfera.
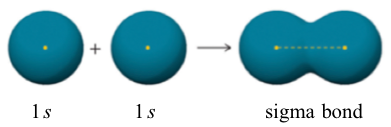
Cuando dos átomos de hidrógeno se acercan entre sí, los dos orbitales 1s se superponen, permitiendo que los dos electrones (cada H dona 1 electrón) se emparejen para el enlace con los orbitales superpuestos. El par compartido de electrones están bajo la atracción de ambos núcleos de hidrógeno simultáneamente, lo que da como resultado que sirvan como un “pegamento” que mantiene los dos núcleos juntos.
Los cambios globales de energía del sistema frente a la distancia entre los dos núcleos de hidrógeno se pueden resumir en el diagrama de energía a continuación.
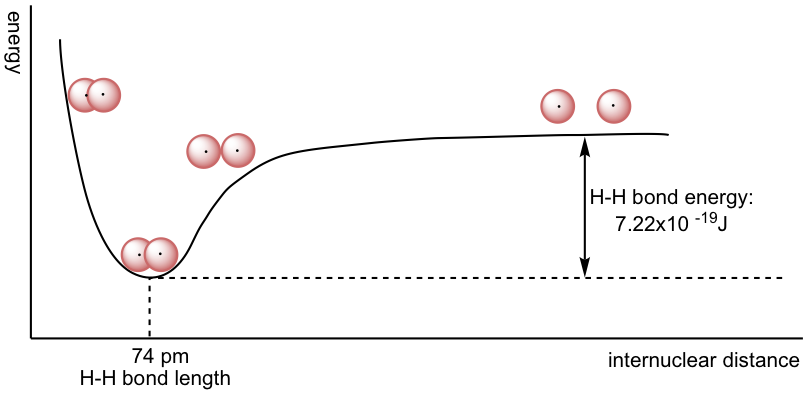
Cuando los dos átomos están separados, no hay superposición ni interacción. A medida que se acercan, los orbitales comienzan a superponerse, y hay atracción entre el núcleo de un átomo y el electrón del otro átomo, por lo que la energía total del sistema disminuye. La energía disminuye a su nivel mínimo cuando los dos átomos se acercan a la distancia óptima. La distancia óptima también se define como la longitud de unión. Las moléculas H 2 tienen una longitud de enlace de 74 pm (a menudo referidas como 0.74 Å, 1Å= 10 -10 m). La diferencia de energía entre el estado más estable (estado de energía más bajo con distancia óptima) y el estado en el que los dos átomos están completamente separados se denomina energía de enlace (disociación). La energía de enlace es 7.22×10 -19 J para un enlace H-H, o 435kJ/mol.
Cuando los dos átomos se acercan más que la distancia óptima, la repulsión entre los dos núcleos se vuelve predominante, y la energía del sistema se vuelve aún mayor.
Otro carácter importante del enlace covalente en H 2 es que los dos orbitales 1s se superponen de una manera que se conoce como cabeza a cabeza. El enlace formado por superposición de cabeza a cabeza se denomina enlace σ (sigma). Los enlaces σ son simétricos en forma cilíndrica, lo que significa que si se toma un plano de sección transversal del enlace en cualquier punto, formaría un círculo.
La teoría del enlace de valencia también funciona bien para explicar la unión en HF, con el orbital 2p del átomo de flúor involucrado en el solapamiento.
El átomo de flúor tiene la configuración electrónica de valencia de 2s 2 2p 5 como se muestra en el diagrama orbital.
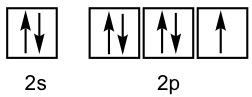
Para los tres orbitales de 2p, dos de ellos están llenos y el otro está medio lleno con un solo electrón. El orbital lleno no puede formar enlaces, por lo que solo el 2p medio lleno está disponible para solapamiento. Por lo tanto, el orbital 1s del átomo de hidrógeno se solapa cabeza a cabeza con el orbital 2p medio lleno del átomo de flúor para formar el enlace H-F σ, como se muestra a continuación.
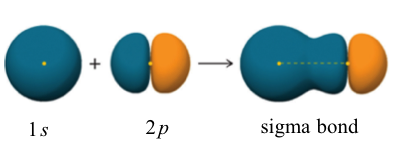
También se puede formar un enlace σ a través del solapamiento de dos orbitales p. El enlace covalente en flúor molecular, F 2, es un enlace σ formado por el solapamiento de dos orbitales medio llenos 2 p, uno de cada átomo de flúor como se muestra aquí.
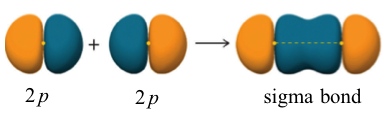
Sin embargo, cuando la teoría del enlace de valencia se aplica a moléculas orgánicas, por ejemplo CH 4, no funciona. La configuración electrónica de valencia del átomo de carbono es 2s 2 2p 2 como se muestra en el diagrama orbital.
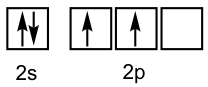
Con base en la teoría de los enlaces de valencia, con dos orbitales medio llenos disponibles, el átomo de carbono debería ser capaz de formar dos enlaces. Sin embargo, el carbono siempre tiene cuatro enlaces en cualquier compuesto orgánico estable. Para explicar la unión del carbono y otros átomos que no pueden encajar en la teoría del enlace de valencia simple, se introducirá una nueva teoría llamada hibridación orbital como complemento de la teoría del enlace de valencia.
1.6.2 Hibridación y estructura de CH 4
En pocas palabras, hibridación significa la combinación matemática de varios orbitales para generar un conjunto de nuevos orbitales híbridos.
En la hibridación para CH 4, se combinan los orbitales 2s y tres 2p para dar un nuevo conjunto de cuatro orbitales idénticos, que se denominan orbitales híbridos sp 3. El símbolo sp 3 aquí identifica los números y tipos de orbitales involucrados en la hibridación: orbitales uno s y tres p. Para el proceso de hibridación,
número de orbitales híbridos = el número total de orbitales atómicos que se combinan
Significa que con un total de cuatro orbitales combinados, se generan cuatro nuevos orbitales híbridos, y todos ellos nombrados como orbitales híbridos sp 3. Estos nuevos orbitales híbridos están todos en el mismo nivel de energía que se encuentra entre los de los orbitales 2s y 2p, y se dirigen en forma tetraédrica en general con el ángulo entre dos orbitales cualesquiera como 109.5°. Cada orbital híbrido sp 3 tiene dos lóbulos que son muy diferentes en tamaño. El lóbulo con el tamaño más grande se encuentra en la fase positiva y es responsable de la unión.
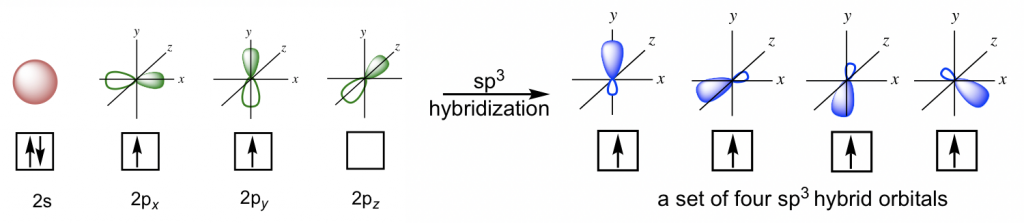

Dado que hay cuatro orbitales híbridos sp 3 disponibles, cada uno de los cuatro electrones de valencia ocupa uno de ellos, por lo que hay cuatro orbitales sp 3 medio llenos en el átomo de carbono que son capaces de formar cuatro enlaces. Por lo tanto, el enlace C-H de CH 4 está formado por el solapamiento entre el orbital 1s en el átomo de hidrógeno y el orbital sp 3 en el átomo de carbono.
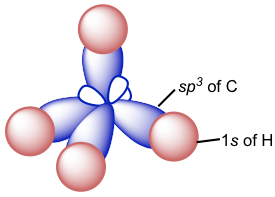
Debido a que la disposición de los cuatro orbitales híbridos sp 3 está en un tetraédrico, la forma de la molécula CH 4 también es tetraédrica, lo cual es consistente con la forma predicha por VSEPR. La forma tetraédrica del carbono sp 3 generalmente se puede dibujar usando las cuñas sólidas y discontinuas. De los cuatro enlaces, los dos enlaces que se encuentran dentro del plano del papel se muestran como líneas ordinarias, la cuña sólida representa un enlace que apunta hacia fuera del plano del papel, y la cuña discontinua representa un enlace que apunta detrás del plano de papel. Estos dibujos en perspectiva que muestran la forma tetraédrica 3D son particularmente importantes en la discusión de la estereoquímica en el Capítulo 5.

1.6.3 Hibridación y VSEPR
Aparte de la hibridación sp 3, también existen otros tipos de hibridación que incluyen sp, sp 2, sp 3 d y sp 3 d 2. Por lo general, la hibridación en un determinado átomo se puede determinar simplemente contando el número total de grupos de electrones (pares de enlace y pares solitarios). El número total de grupos de electrones es igual al número total de orbitales involucrados en la cierta hibridación. Por ejemplo, en una molécula CH 4, el átomo de carbono central tiene cuatro 4 pares de enlaces, por lo que la hibridación del carbono es sp 3 (uno s y tres p orbitales, 1+3=4). Si un átomo central tiene un total de cinco 5 grupos de electrones (pares de enlace y pares solitarios todos juntos) alrededor, entonces la hibridación es sp 3 d (orbitales uno s, tres p y uno d, 1+3+1=5).
Esta correlación puede recordarle a VSEPR. Hibridación y VSEPR son dos conceptos separados, sin embargo pueden correlacionarse entre sí a través del número de grupos de electrones en común. La siguiente tabla es muy útil para correlacionar la hibridación y los ángulos de forma/enlace VSEPR alrededor del átomo central y el número total de grupos de electrones juntos.
|
Hibridación en átomo central
|
Número total de pares de electrones (BP y LP) alrededor del átomo central |
Geometría (Forma) de grupos de electrones (pares de electrones) |
|
sp |
2 |
lineal |
| sp 2 | 3 | plano trigonal |
| sp 3 | 4 | tetraédrico |
| sp 3 d | 5 | bipiramidal trigonal |
| sp 3 d 2 | 6 | octaédrico |
Ejercicios 1.8
- ¿Cuál es la hibridación del átomo de oxígeno en la molécula H 2 O?
- ¿Cuál es la hibridación del átomo de xenón en la molécula xEF 4 y cuál es la forma de toda la molécula?
1.6.4 La Hibridación y VSEPR en Moléculas Orgánicas
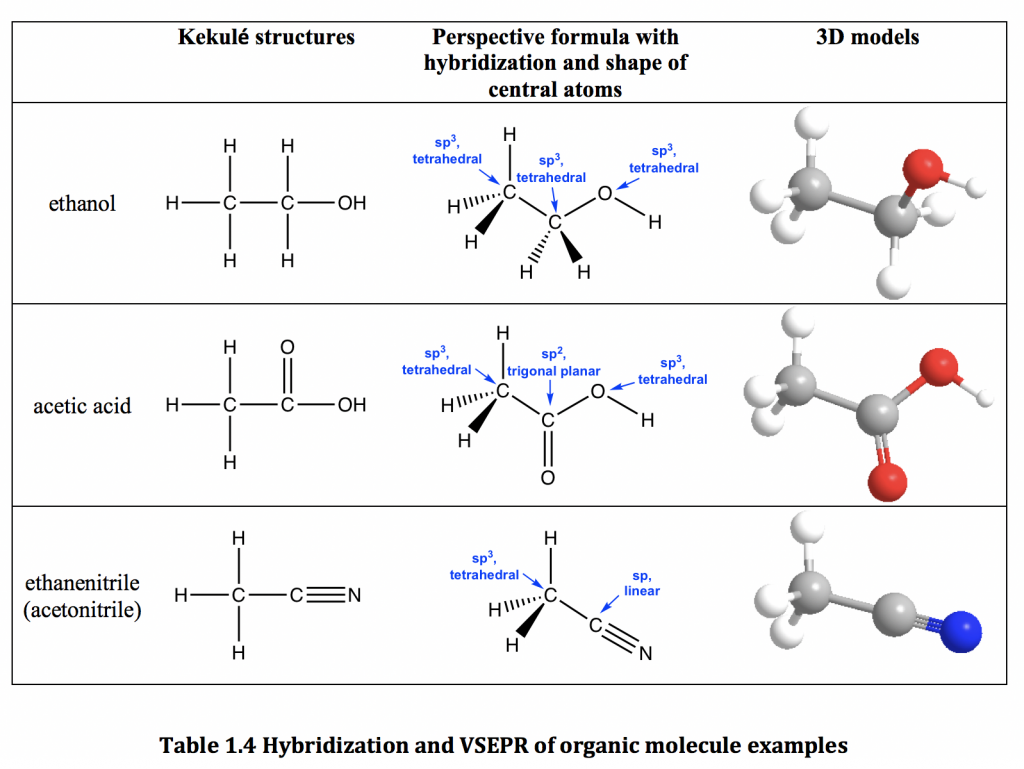
Las moléculas orgánicas suelen contener más de un átomo central, por lo que no es práctico nombrar la forma de toda la molécula; en cambio podemos hablar de la forma/ángulo de enlace sobre cada átomo central individualmente. Para tales fines, asegúrese de incluir los pares solitarios que suelen quedar fuera en las estructuras orgánicas (consulte la sección 1.2.4). Las diferentes fórmulas estructurales de las moléculas de etanol, ácido acético y etanitrilo se muestran en la siguiente tabla. También se muestra el modelo molecular 3D para cada compuesto para ayudarle a visualizar la disposición espacial. Podemos ver que las formas de hibridación y VSEPR necesitan indicarse para cada átomo interno por separado. Tomando como ejemplo el átomo de oxígeno en el grupo OH del etanol, ya que también hay dos pares de electrones de pares solitarios en el átomo de oxígeno (omitidos en las estructuras de la tabla), el oxígeno tiene hibridación sp 3 y está en forma tetraédrica.
1.6.5 Enlaces Múltiples en Estructura Orgánica
Eteno (C 2 H 4)
Tomaremos Eteno (C 2 H 4) como ejemplo para entender la estructura de un doble enlace.
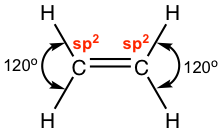
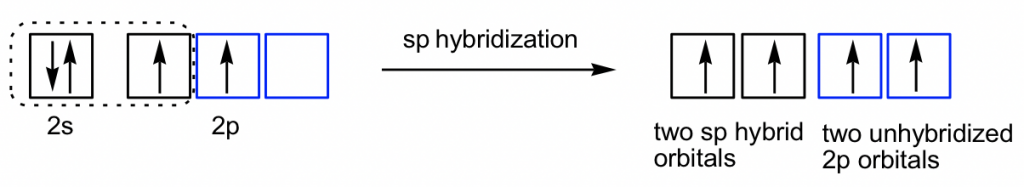
De acuerdo con la fórmula estructural de C 2 H 4, hay tres grupos de electrones alrededor de cada carbono. Mediante referencia al Cuadro 1.3 se determina que ambos carbonos están en hibridación sp 2, con la forma plana trigonal y un ángulo de enlace de 120°. ¿Qué significa la hibridación sp 2 con el átomo de carbono en este compuesto? Significa que solo tres orbitales están involucrados en la hibridación (uno 2 s y dos de 2 p orbitales) del total de cuatro, y hay un orbital 2p omitido, o no incluido en la hibridación, que se llama 2p no hibridado.
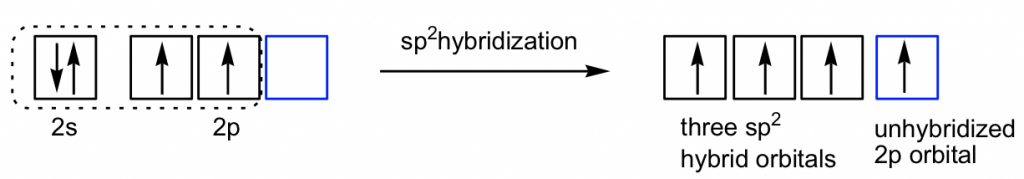
Los tres nuevos orbitales híbridos sp 2 y el 2p no hibridado se dirigen en la siguiente disposición: los tres orbitales híbridos sp 2 están en la forma plana trigonal, y el 2p no hibridado está en la posición perpendicular al plano. Cada orbital tiene un solo electrón, por lo que todos los orbitales están medio llenos y están disponibles para la unión. Ambos átomos de carbono tienen el mismo conjunto de orbitales (tres sp 2 híbridos orbitales y uno no hibridado 2p) como se muestra a continuación.


Cuando los dos carbonos se acercan entre sí, el sp 2 en el eje x se solapa cabeza a cabeza para formar el enlace C-C σ sigma, y el 2p “no hibridado” se solapa lado a lado para formar otro nuevo enlace. El solapamiento orbital lado a lado forma el enlace π (pi).
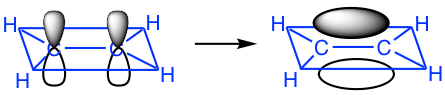
Entonces ahora entendemos que el doble enlace C=C contiene dos enlaces diferentes: el enlace σ (sigma) del solapamiento orbital sp 2 —sp 2 y el enlace π (pi) del 2p—2p superpuesto. Debido al enlace π, la forma general de toda la molécula C 2 H 4 es coplanar.
Los otros orbitales híbridos sp 2 en cada átomo de carbono se superponen con 1s orbitales de átomos de H y dan un total de cuatro enlaces C-H σ (sigma).
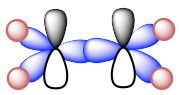
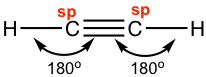
Ethyne C 2 H 2 (nombre común es acetileno) tiene un triple enlace C=C. Generalmente, los enlaces triples implican un enlace σ sigma y dos enlaces π (pi). Ambos átomos de carbono están en hibridación sp y en forma lineal. Con hibridación sp, cada carbono tiene dos orbitales híbridos sp y dos orbitales 2p no hibridados. Cada carbono usa un orbital híbrido sp para superponerse cabeza a cabeza y le da al C-C el enlace σ sigma, mientras que los orbitales 2p se superponen lado a lado para dar dos enlaces π como se muestra en el diagrama a continuación. Los otros orbitales sp se utilizan para superponerse con 1s de átomos de hidrógeno para formar enlaces C-H σ.
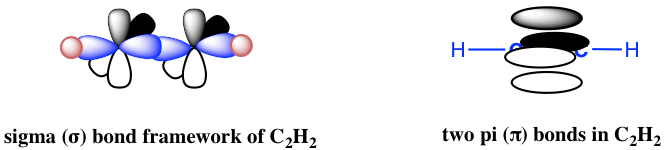
Descripciones de las imágenes
Cuadro 1.4 Descripción de la imagen: Los CH 3, CH 2 y OH de etanol están todos en forma tetraédrica sp 3. El ácido acético CH 3 y el OH están en forma tetraédrica sp 3 y el CO está en un plano trigonal sp 2. Por último, el etanonitrilo (acetonitrilo) CH 3 en forma tetraédrica sp 3, y el CN está en forma lineal sp. [Volver a la Tabla 1.4]


