2.1: Estructuras de Alquenos
- Page ID
- 76528
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)2.1.1 Estructuras y Diferentes Fórmulas Estructurales
El alcano es el hidrocarburo más simple con solo enlaces simples C-C. El alcano de cadena se ajusta a la fórmula general de C n H 2n+2 (n: entero positivo), y el número de átomos de H alcanza el nivel máximo en alcanos de cadena. Los nombres y estructuras de alcanos de cadena lineal de hasta diez carbonos se enumeran en la siguiente tabla.
| Cantidad de Carbones | Nombre |
Fórmula (C n H 2n+2) |
Estructura condensada |
| 1 | metano | CH 4 | CH 4 |
| 2 | etano | C 2 H 6 | CH 3 CH 3 |
| 3 | propano | C 3 H 8 | CH 3 CH 2 CH 3 |
| 4 | butano | C 4 H 10 | CH 3 CH 2 CH 2 CH 3 |
| 5 | pentano | C 5 H 12 | CH 3 CH 2 CH 2 CH 2 CH 3 |
| 6 | hexano | C 6 H 14 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 3 |
| 7 | heptano | C 7 H 16 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
| 8 | octano | C 8 H 18 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
| 9 | nonano | C 9 H 20 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
| 10 | decano | C 10 H 22 | CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 3 |
Tabla 2.1 Nombres y estructuras de alcanos de cadena lineal
Las fuentes primarias de alcanos son el gas natural y el petróleo. El gas natural contiene principalmente metano (70 — 90%) y algo de etano. La refinación de petróleo separa el petróleo crudo en diferentes fracciones y cada fracción consiste en alcanos de similar número de carbonos. El propano y el butano son combustibles comunes en los quemadores de gas propano y encendedores de cigarrillos. Los alcanos con 5 a 8 carbonos son los principales componentes de la gasolina, mientras que el diesel contiene alcanos que van de 9 a 16 carbonos. A medida que aumenta el número de carbonos, aumenta el punto de ebullición y la viscosidad de los alcanos.
Hay una variedad de formatos para mostrar las fórmulas estructurales de los compuestos orgánicos, es importante poder reconocer diferentes dibujos de fórmulas, y utilizarlos correctamente para representar las estructuras.
Kekul é Estructura
Hemos tenido algunas discusiones sobre las estructuras de Kekulé en la sección 1.2.4. Son similares a las estructuras de Lewis con todos los electrones de enlace mostrados en líneas cortas y todos los átomos incluidos como símbolos de elementos. Sin embargo, los electrones de pares solidos se dejan fuera en las estructuras de Kekulé, que es la principal diferencia entre las estructuras de Kekulé del compuesto orgánico y las estructuras de Lewis.

Fórmula de estructura condensada
En las fórmulas de estructura condensada, se omiten los enlaces C-H y todos los átomos de H unidos a cierto carbono (u otros átomos) generalmente se muestran como un grupo como CH 3, CH 2, NH 2, OH. Las estructuras en la Tabla 2.1 se muestran como estructuras condensadas. El enlace C-C a veces también se puede omitir (como para 2-metilpropano y 2-hexanol en los ejemplos a continuación). Por lo general, si la estructura tiene una rama, la unión entre la estructura padre y la rama debe mostrarse con una línea corta. Es más rápido dibujar una estructura con fórmula de estructura condensada, y la estructura no parece tan voluminosa como las estructuras de Kekulé.

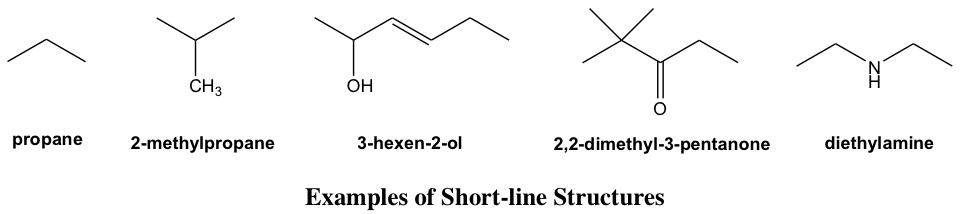
Fórmula de estructura de línea corta
El dibujo de la estructura puede simplificarse aún más por la estructura de línea corta (o “estructura de línea de enlace”, “fórmula esquelética” en otros libros) con la mayoría de los átomos omitidos, también es el tipo muy común de fórmula estructural utilizada en Química Orgánica por su simplicidad. Para aplicar e interpretar correctamente las estructuras de líneas cortas, es muy importante entender claramente las convenciones de este tipo de dibujo.
- Cada línea corta representa un enlace.
- Las cadenas de carbono se muestran en forma de zig-zag.
- No se muestran átomos de carbono (como excepción, es opcional mostrar el grupo CH 3 al final de la cadena, o como una ramificación); cada curva en una línea o término de una línea representa un átomo de carbono, a menos que se muestre explícitamente otro átomo.
- Los átomos de hidrógeno unidos a los carbonos no se muestran; los átomos de hidrógeno unidos a otros átomos se muestran explícitamente.
- Átomos distintos de C y H, por ejemplo N, O, Cl, necesitan mostrarse explícitamente.
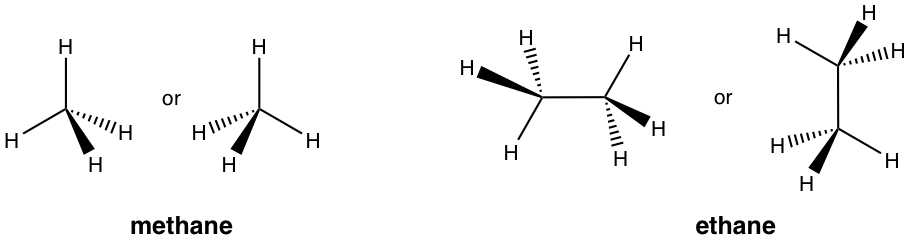
Fórmula en perspectiva de la estructura 3D
Cuando es necesario resaltar la disposición espacial de grupos alrededor de un carbono tetraédrico sp 3 para fines de conformación (Capítulo 4) o estereoquímica (Capítulo 5), se utiliza la fórmula de perspectiva con cuñas sólidas y discontinuas. De los cuatro enlaces en un carbono tetraédrico, dos enlaces se encuentran dentro del plano del papel y se muestran como líneas ordinarias, la cuña sólida representa un enlace que apunta hacia fuera del plano del papel, y la cuña discontinua representa un enlace que apunta detrás del plano del papel.
2.1.2 Isómeros constitucionales
Para metano, etano y propano, solo hay una forma de arreglo de carbono. A medida que el número de carbonos aumenta a 4 carbonos, hay dos formas de conectar los átomos de carbono, una como cadena lineal (estructura azul abajo), y la otra como una rama en la cadena (estructura roja abajo).
| Dos isómeros constitucionales con fórmula C 4 H 10 | |

|
|
| Butano |
Isobutano (i-butano) “iso” significa “isomérico” |
|
b.p. = 0 °C |
b.p. = -12 °C |
| densidad: 0.622 g/mL | densidad: 0.604 g/mL |
Como podemos ver, estas dos estructuras diferentes representan dos compuestos diferentes, con diferentes nombres y diferentes propiedades físicas; sin embargo, ambas tienen la misma fórmula de C 4 H 10, y se denominan isómeros constitucionales (estructurales). Los isómeros constitucionales (estructurales) son compuestos diferentes con la misma fórmula molecular, pero sus átomos dispuestos en un orden diferente. (es decir, los átomos están unidos de diferentes maneras.)
Veamos más ejemplos de isómeros constitucionales.
Para los alcanos con 5 carbonos, hay un total de tres isómeros constitucionales. Verifique las notas además de la estrategia para construir isómeros constitucionales.


Ejercicios 2.1
Dibujar todos los isómeros constitucionales con una fórmula de C 7 H 16.
Respuestas a las preguntas de práctica Capítulo 2
Los isómeros constitucionales que tenemos hasta ahora tienen diferentes longitudes de “cadenas principales” de carbono, y también se denominan isómeros constitucionales esqueléticos. Las otras situaciones posibles incluyen isómeros constitucionales posicionales y funcionales que encontraremos más adelante.
A medida que aumenta el número de carbonos, el número de isómeros constitucionales aumenta dramáticamente. Para el ejemplo de alcanos con 20 carbonos, es decir C 20 H 42, existen 366,319 isómeros constitucionales. Si bien no existe una fórmula simple que permita predecir el número total de isómeros para una cierta cantidad de carbonos, el fenómeno de los isómeros constitucionales explica parcialmente la alta diversidad de estructuras orgánicas.
2.1.3 Reconocimiento de 1 °, 2 °, 3 °, 4 ° de carbonos
Los átomos de carbono en estructura orgánica pueden clasificarse como primarios (1°), secundarios (2°), terciarios (3°) y cuaternarios (4°), dependiendo de cuántos otros carbonos se conecte con. Específicamente:
- Carbono primario (1°): unido directamente solo a otro átomo de C;
- Carbono secundario (2°): unido directamente a otros dos átomos de C;
- Carbono terciario (3°): unido directamente a otros tres átomos de C;
- Carbono cuaternario (4°): unido a otros cuatro átomos de C.
Los átomos de hidrógeno unidos en 1°, 2° y 3° de carbono, están marcados como 1°, 2° y 3° hidrógeno respectivamente.

En un compuesto, los carbonos (o hidrógenos) que pertenecen a una categoría diferente muestran diferentes propiedades estructurales y reactivas. Este concepto tiene muchas más aplicaciones en secciones posteriores.


