2.6: Fuerza Intermolecular y Propiedades Físicas de Compuestos Orgánicos
- Page ID
- 76542
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
2.6.1 Fuerzas intermoleculares
En Química Orgánica, la comprensión de las propiedades físicas de los compuestos orgánicos, por ejemplo el punto de ebullición (p.e.), la polaridad molecular y la solubilidad, es muy importante. Nos proporciona información útil sobre cómo tratar una sustancia de la manera adecuada. Esas propiedades físicas están esencialmente determinadas por las fuerzas intermoleculares involucradas. Las fuerzas intermoleculares son la fuerza atractiva entre las moléculas y que mantienen unidas a las moléculas; es una fuerza eléctrica en la naturaleza. Nos centraremos en tres tipos de fuerzas intermoleculares: fuerzas de dispersión, fuerzas dipolo-dipolo y enlaces de hidrógeno.
Fuerzas de Dispersión
Las Fuerzas de Dispersión (también llamadas Fuerzas de Londres) resultan del dipolo instantáneo y del dipolo inducido de las moléculas. Para las moléculas no polares, el constante desplazamiento y distorsión de la densidad electrónica conduce a un dipolo débil de corta duración en un momento dado, que se llama dipolo instantáneo. Dichos dipolos temporales inducirán a que los electrones de una molécula vecina se distorsionen también y desarrollen un dipolo transitorio correspondiente propio, que es el dipolo inducido. Al final, todas las moléculas no polares son atraídas juntas a través de los dos tipos de dipolos temporales como se muestra en la Fig. 2.6a. La fuerza de dispersión es de naturaleza débil, y es la fuerza intermolecular más débil. Sin embargo, dado que se aplica a todo tipo de moléculas (es la única fuerza intermolecular para las moléculas no polares), las fuerzas de dispersión son también la fuerza intermolecular más fundamental.

La magnitud de las fuerzas de dispersión depende de dos factores:
- La polarizabilidad relativa de los electrones. La simple comprensión de la polarizabilidad es la facilidad con la que se distorsionan los electrones. Para átomos más grandes, hay más electrones en un espacio más grande, por lo tanto los electrones se sujetan más flojamente y se polarizan más fácilmente, por lo que la fuerza de dispersión es más fuerte. Generalmente, cuanto mayor es la masa molar de la molécula, más fuerte es la fuerza de dispersión.
- El área de superficie relativa de la molécula. Las moléculas con formas más largas, planas o cilíndricas tienen una mayor superficie en comparación con las moléculas voluminosas y ramificadas, y por lo tanto tienen una fuerza de dispersión más fuerte. Tomando como ejemplo los dos isómeros constitucionales de C 4 H 10 (sección 2.1.2), butano e isobutano, la fuerza de dispersión del butano es más fuerte que la del isobutano.

Fuerza dipolo-dipolo
Para las moléculas polares, las moléculas son atraídas entre sí debido a un dipolo permanente, y este tipo de fuerza de atracción se llama fuerza dipolo-dipolo. Como se muestra a continuación en el mapa de potencial electrostático de la acetona, un extremo de la acetona tiene una carga negativa parcial (rojo) y el otro extremo tiene una carga positiva parcial (azul). La fuerza dipolo-dipolo es una fuerza de atracción entre el extremo positivo de una molécula y el extremo negativo de la molécula vecina.

Enlaces de hidrógeno
En primer lugar, ¡no dejes que el nombre te engañe! Aunque se le llama “enlace”, un enlace de hidrógeno no es un enlace covalente, es un tipo de fuerza intermolecular. El enlace de hidrógeno es la fuerza entre un átomo de H que está unido a O, N o F (átomos con alta electronegatividad) y el átomo electronegativo vecino,. Se puede mostrar de manera general como:

El ejemplo más común de enlaces de hidrógeno es para las moléculas de agua. El agua tiene dos enlaces O-H, y ambos están disponibles como donantes de enlaces de hidrógeno para moléculas vecinas. Esto explica el extraordinariamente alto b.p. del agua (100 °C), considerando la masa molar bastante pequeña de 18.0 g/mol. Como comparación, la molécula de metano CH 4 con un tamaño similar tiene un p.p. de -167.7 °C.

Para los compuestos orgánicos, los enlaces de hidrógeno juegan un papel importante en la determinación de las propiedades de compuestos con enlaces OH o NH, por ejemplo alcohol (R-OH), ácido carboxílico (R-COOH), amina (R-NH 2) y amida RCONH 2.
Los tres tipos principales de fuerzas intermoleculares se resumen y se comparan en el Cuadro 2.6.

Moléculas polares vs no polares
Como se indica en el Cuadro 2.6, la naturaleza de la polaridad molecular determina los tipos de fuerza (s) aplicada (s) a una determinada sustancia. Entonces aquí tendremos discusiones sobre cómo saber si una molécula es polar o no polar.
La polaridad del compuesto se puede determinar por su fórmula y forma.
Para las moléculas diatómicas, la polaridad molecular es la misma que la polaridad de unión. Eso significa que todas las moléculas homonucleares, como H 2, N 2, O 2, F 2, son no polares debido a su enlace no polar, mientras que todas las moléculas heteronucleares, como HF, HCl, son polares.
Para las moléculas poliatómicas, la polaridad molecular también depende de la forma (consulte VSEPR en la Sección 1.5) de la molécula. Veamos los ejemplos de H 2 O y CO 2.
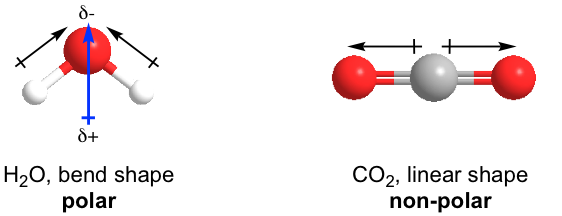
Tanto H 2 O como CO 2 tienen dos enlaces polares. H 2 O está en la forma doblada, por lo que las polaridades de enlace de los dos enlaces O-H se suman para dar la polaridad molecular de toda la molécula (mostrada anteriormente), por lo que H 2 O es molécula polar. Por otro lado, la forma del CO 2 es lineal, y las polaridades de enlace de los dos enlaces C=O se cancelan, por lo que toda la molécula de CO 2 es no polar.
Hay otros ejemplos de moléculas no polares donde se cancela la polaridad del enlace, como BF 3, CCl 4, PCl 5, XEo 4 etc.
Para los compuestos orgánicos, los hidrocarburos (C x H y) son siempre no polares. Esto se debe principalmente a la pequeña diferencia de electronegatividad entre los átomos de carbono y los átomos de hidrógeno, haciendo enlaces C-H técnicamente no polares.
Para otros compuestos orgánicos que contienen grupos funcionales con heteroátomos, como R-O-R, C=O, OH, NH, todos son moléculas polares.
El diagrama aquí (Fig. 2.6g) proporciona un resumen de todas las discusiones sobre polaridades moleculares.

Aparte de los tres tipos de fuerzas intermoleculares, existe otra interacción que es muy importante para comprender la propiedad física de un compuesto, que es la fuerza ión-dipolo.
Fuerza ión-dipolo
La fuerza ión-dipolo no se clasifica como una fuerza intermolecular, sin embargo es un tipo de fuerza no covalente importante que es responsable de la interacción entre los iones y otra sustancia polar. Un ejemplo sencillo es la disolución de un sólido iónico, o sal, en agua. Cuando la sal de mesa (NaCl) se disuelve en agua, las interacciones entre los iones y las moléculas de agua son lo suficientemente fuertes como para superar el enlace iónico que retiene los iones en la red cristalina. Como resultado, los cationes y aniones se separan completamente, y cada ion está rodeado por un cúmulo de moléculas de agua. Esto se llama un proceso de solvatación. La solvatación ocurre a través de la fuerte fuerza ión-dipolo. Las sales de lotes, o compuestos iónicos, son solubles en agua debido a tales interacciones.
2.6.2 Propiedades físicas y fuerzas intermoleculares
La comprensión de las fuerzas intermoleculares nos ayuda a comprender y explicar las propiedades físicas de las sustancias, ya que son las fuerzas intermoleculares las que dan cuenta de propiedades físicas como fases, puntos de ebullición, puntos de fusión, viscosidades, etc. Para fines de química orgánica, nos centraremos en la ebullición punto (b.p.) y solubilidad.
Punto de ebullición (p.e.):
La tendencia del punto de ebullición de diferentes sustancias se correlaciona directamente con las fuerzas intermoleculares totales. En términos generales, cuanto más fuerte es la fuerza intermolecular general aplicada a una determinada sustancia, mayor es el punto de ebullición de la sustancia. El punto de ebullición es la temperatura a la que la fase líquida de la sustancia se vaporiza para convertirse en un gas. Para vaporizar un líquido, se deben superar las fuerzas intermoleculares que mantienen unidas a las moléculas. Cuanto más fuertes sean las fuerzas, más energía se necesita para superar las fuerzas, y se requiere una temperatura más alta, lo que conduce a un punto de ebullición más alto.
Ejemplo:
Los tres compuestos aquí tienen Masas Molares similares, por lo que las fuerzas de dispersión están en un nivel similar. Sin embargo, los tres compuestos tienen diferentes polaridades moleculares. El butano es una sustancia no polar que solo tiene fuerzas de dispersión, el propanal es una molécula polar con fuerzas de dispersión y fuerzas dipolo-dipolo, y el propanol es una molécula polar con un enlace OH, por lo que los tres tipos de fuerzas se aplican a. Por lo tanto, la cantidad total de fuerzas intermoleculares es más fuerte para el propanol, y más débil para el butano, que está en el mismo orden que sus puntos de ebullición.
Solubilidad:
Una regla general para la solubilidad se resume mediante la expresión “como se disuelve como”. Esto significa que una sustancia puede disolverse en otra con polaridad similar, y como resultado, con fuerzas intermoleculares similares. Más específicamente:
- Las sustancias no polares suelen ser solubles en disolventes no polares.
- Las sustancias polares e iónicas suelen ser solubles en disolventes polares.
- Las sustancias polares y no polares son insolubles entre sí.
Determinar la polaridad de una sustancia ya se ha resumido en una parte anterior de esta sección (Fig. 2.6g). El agua, el metanol y el etanol son ejemplos de solventes muy polares que pueden formar enlaces de hidrógeno. Éter, cetona, haluro y ésteres también son disolventes polares, pero no tan polares como el agua o el metanol. Los disolventes no polares incluyen hidrocarburos como hexano, benceno, tolueno, etc.
Para algunos compuestos orgánicos, sin embargo, puede que no sea tan fácil llamarlo simplemente polar o no polar, porque parte del compuesto puede ser polar, y la otra parte puede ser no polar. Esto a menudo se describe como hidrófilo o hidrófobo.
- Hidrofóbico (hidro, agua; fóbico: temer o evitar) lo que significa que no le gusta el agua, o es insoluble en agua;
- Hidrofílico (hidro, agua; fílico: amar o buscar) lo que significa que le gusta el agua, o es soluble en agua.

La parte hidrocarbonada del compuesto orgánico es hidrofóbica, porque es no polar y por lo tanto no se disuelve en agua polar. El grupo funcional de OH, COOH, NH 2 etc es polar y por lo tanto es hidrofílico. Con partes tanto hidrofóbicas como hidrófilas presentes en un compuesto orgánico, la polaridad general depende de la parte principal. Si la cadena de carbono es corta (1 ~ 3 carbonos), el efecto hidrófilo del grupo polar es el principal, por lo que todo el compuesto es soluble en agua; con cadenas de carbono de 4 ~ 5 carbonos, el efecto hidrófobo comienza a superar el efecto hidrófilo y se pierde la solubilidad en agua.
Las diferencias de solubilidad de diferentes alcoholes demuestran esta tendencia claramente; a medida que aumenta la longitud de la cadena carbonada, la solubilidad del alcohol en agua disminuye drásticamente (Cuadro 2.7):
| Alcohol |
Solubilidad en agua (g/100 ml) |
| metanol, etanol, propanol
(CH 3 OH, CH 3 CH 2 OH, CH 3 CH 2 CH 2 OH) |
miscible (disolver en todas las proporciones) |
| 1-butanol (CH 3 CH 2 CH 2 CH 2 OH) |
9 |
| 1-pentanol (CH 3 CH 2 CH 2 CH 2 CH 2 OH) |
2.7 |
| 1-octanol (CH 3 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 CH 2 OH) |
0.06 |
Cuadro 2.7 Solubilidad de diferentes alcoholes en agua
Para los compuestos orgánicos que son insolubles en agua, a veces se pueden convertir en el “derivado de sal” a través de una reacción adecuada, y así pueden volverse solubles en agua. Este método se usa comúnmente en laboratorios para la separación de compuestos orgánicos.
Ejemplo:

La aplicación de reacciones ácido-base es la forma más común de lograr tales propósitos. Como se muestra en el ejemplo anterior, al agregar una base fuerte al ácido benzoico, se produce una reacción ácido-base y el ácido benzoico se convierte en su sal, el benzoato de sodio, que es soluble en agua (debido a la fuerza ión-dipolo como aprendimos anteriormente). Por lo tanto, el ácido benzoico puede ser llevado a la fase acuosa (acuosa), y separado de otros compuestos orgánicos que no tienen propiedades similares.


