3.1: Revisión de Ácidos y Bases y Ka
- Page ID
- 76350
15
La definición más comúnmente aplicada de ácidos y bases es la definición de Brønsted-Lowry:
- Br ø nsted -Lowry Acid: una sustancia que puede donar un protón (H +);
- Br ø nsted -Base Lowry: una sustancia que puede aceptar un protón (H +).
Por lo tanto, según la definición de Brønsted-Lowry, una reacción ácido-base es un proceso de transferencia de protones en el que el ácido regala un protón y la base acepta un protón como se muestra en la ecuación general:
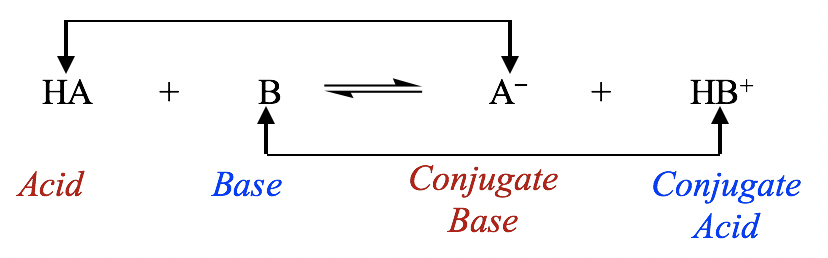
Ecuación general para la reacción ácido-base
La especie que se forma cuando un ácido pierde su protón se llama la base conjugada de ese ácido; de manera similar, la especie que se forma cuando una base acepta un protón se llama el ácido conjugado de esa base. En la ecuación general anterior, HA es el ácido conjugado de A —, y A — es la base conjugada de HA. HA y A — también se puede llamar un par ácido-base conjugado; otro par es HB + y B.
Un ácido fuerte dona el protón completamente, y la flecha “→” se puede usar en la ecuación de reacción para indicar que la reacción va a completarse. La reacción de disociación del ácido fuerte HCl en agua se utiliza como ejemplo aquí:
HCl (g) + H 2 O (l) →H 3 O + (ac) + Cl — (aq)
Para los ácidos débiles (HA se usa como fórmula general), el protón solo se dona parcialmente y la reacción se mantiene en equilibrio. La flecha de equilibrio “![]() ” será necesaria en la ecuación de reacción para indicar el estado de equilibrio:
” será necesaria en la ecuación de reacción para indicar el estado de equilibrio:
HA (aq) + H 2 O (l) ⇔ H 3 O + (aq) + A — (aq)
La constante de equilibrio para la reacción anterior se denomina constante de disociación ácida, K a. Es una constante para medir la fuerza relativa de un ácido. La expresión para K a es:
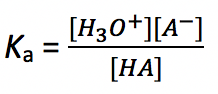
Cuanto mayor es el valor de K a, más fuerte es la capacidad del ácido para donar protones, y más fuerte es el ácido. (Técnicamente, cuando el valor K a es mayor que 10, el ácido puede considerarse como un ácido fuerte).
Para el par conjugado ácido-base, cuanto más fuerte es el ácido, más débil es la base conjugada, y viceversa.

