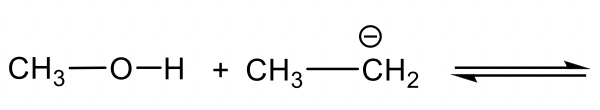3.2: Ácidos y Bases Orgánicos y Mecanismo de Reacción Orgánica
- Page ID
- 76349
3.2.1 Ácidos orgánicos
Los ácidos de los que hablamos en Química General generalmente se refieren a ácidos inorgánicos, como HCl, H 2 SO 4, HF etc. Si la estructura del ácido contiene una parte de “carbono”, entonces es un ácido orgánico. Los ácidos orgánicos donan protones de la misma manera que los ácidos inorgánicos, sin embargo la estructura puede ser más complicada debido a la naturaleza de las estructuras orgánicas.
El ácido carboxílico, con la fórmula general de R-COOH, es el ácido orgánico más común con el que estamos familiarizados. El ácido acético (CH 3 COOH), el ingrediente del vinagre, es un ejemplo sencillo de un ácido carboxílico. El K a del ácido acético es 1.8×10 -5.
Otro ácido orgánico común es el derivado orgánico del ácido sulfúrico H 2 SO 4.
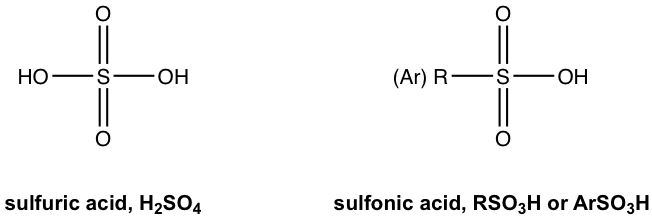
El reemplazo de un grupo OH en H 2 SO 4 con un grupo R (alquilo) o Ar (aromático) que contiene carbono conduce al ácido orgánico denominado “ácido sulfónico”, con la fórmula general de RSO 3 H, o ArSO 3 H. El ácido sulfónico es un ácido orgánico fuerte con un K a en el rango de 10 6. La estructura de un ejemplo específico de ácido sulfónico llamado ácido p-toluensulfónico se muestra aquí:

Aparte de los ácidos aquí mencionados, técnicamente cualquier compuesto orgánico podría ser un ácido, porque los compuestos orgánicos siempre tienen átomos de hidrógeno que potencialmente podrían ser donados como H +. Aquí solo se muestran algunos ejemplos con los átomos de hidrógeno resaltados en azul:

Por lo tanto, el alcance de los ácidos se ha ampliado para ser mucho más amplio en un contexto de química orgánica. Tendremos más discusiones sobre la acidez de los compuestos orgánicos en la sección 3.3, y veremos más reacciones ácido-base aplicadas a compuestos orgánicos más adelante en este capítulo.
3.2.2 Bases Orgánicas
Si bien es relativamente sencillo identificar un ácido orgánico ya que los átomos de hidrógeno siempre están involucrados, a veces no es tan fácil identificar bases orgánicas. Según la definición, una base es la especie que es capaz de aceptar el protón. Las bases orgánicas pueden involucrar una variedad de estructuras diferentes, pero todas deben compartir la característica común de tener pares de electrones que sean capaces de aceptar protones. Los pares de electrones podrían ser electrones de pares solitarios en una especie con carga neutra o negativa, o pares de electrones π. Por lo tanto, las bases orgánicas podrían involucrar los siguientes tipos:
- Bases orgánicas cargadas negativamente: RO — (alquilóxido), RNH — (amida), R — (alkide, la base conjugada del alcano). Dado que las bases cargadas negativamente tienen una alta densidad de electrones, suelen ser bases más fuertes que las neutras.
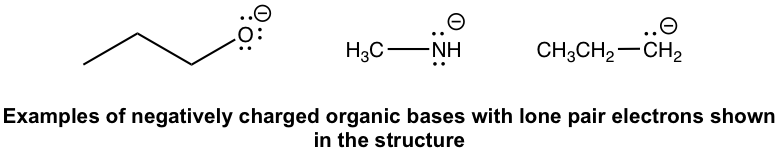
- Bases orgánicas neutras, por ejemplo amina, grupo C=O y grupo C=C
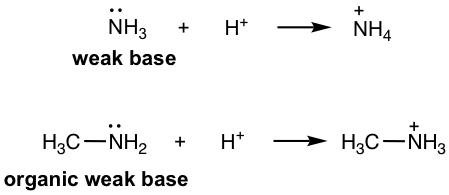
- Amina: RNH 2, R 2 NH, R 3 N, ARNh 2 etc (sección 2.3). Como derivados orgánicos de NH 3, que es una base débil inorgánica, las aminas son bases orgánicas débiles con electrones de par solitario en N que son capaces de aceptar el protón.
-
- Grupos funcionales que contienen átomos de oxígeno: grupo carbonilo C=O, alcohol R-OH, éter R-O-R. Los electrones de par solitario en O en estos grupos son capaces de aceptar el protón, por lo que los grupos funcionales como aldehído, cetona, alcohol y éter son todos bases orgánicas. Puede que no sea tan fácil aceptar este concepto al principio, porque estos grupos realmente no parecen bases. No obstante, son bases según la definición porque son capaces de aceptar el protón con el par solitario en el átomo de oxígeno.
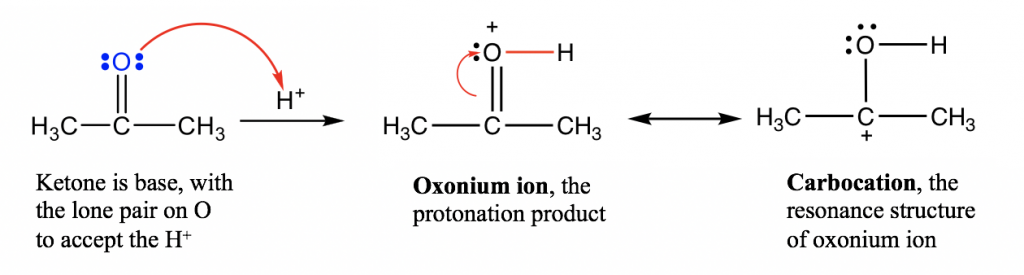
Notas para el mecanismo anterior:
- Para la reacción ácido-base entre el grupo C=O y el protón, la flecha parte del par de electrones en O, y apunta al H + que está recibiendo el par de electrones. Un nuevo enlace O-H se forma como resultado de este movimiento de pares de electrones.
- En esta reacción ácido-base, la cetona es protonada por H +, por lo que esta reacción también puede llamarse la “protonación de cetona”.
- El producto de la protonación se denomina “ion oxonio”, el cual se estabiliza con otra estructura de resonancia, el carbocatión.
-
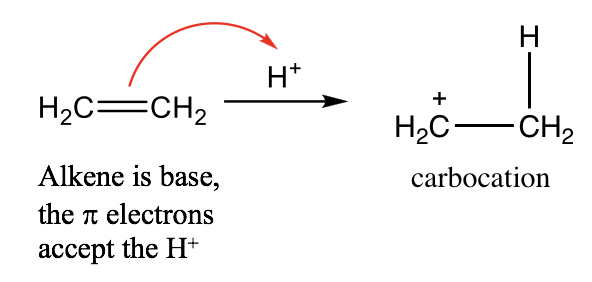
- Alqueno (C=C): Aunque no hay electrones de pares solitarios en el enlace C=C del alqueno, los electrones π del doble enlace C=C son capaces de aceptar protones y actuar como base. Por ejemplo:
Ejemplo: Reacción de ácido orgánico y base
Predecir y dibujar los productos de la siguiente reacción y usar flecha curva para mostrar el mecanismo.
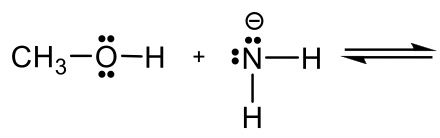
Enfoque: Si H + es el ácido como en ejemplos anteriores, es bastante fácil predecir cómo procederá la reacción. No obstante, si no hay ácido (o base) obvio como en este ejemplo, ¿cómo se determina cuál es el ácido y cuál es la base?
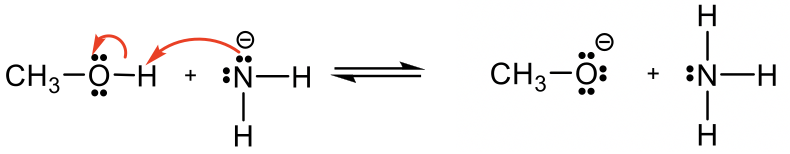
Metanol CH 3 OH es neutro, y el otro reactivo, NH 2 —, es una amida cargada negativamente. La amida con carga negativa tiene mayor densidad electrónica que el metanol neutro, por lo tanto la amida NH 2 — debe actuar como base, y CH 3 OH es el ácido que dona H +.
Solución:
Ejercicios 3.1
Predecir y dibujar los productos de la siguiente reacción y usar flecha curva para mostrar el mecanismo.