3.5: Ácidos de Lewis y Bases de Lewis
- Page ID
- 76358
La definición de Brønsted-Lowry funciona bien para las reacciones que aprendimos hasta ahora, sin embargo, también limita el alcance de las reacciones ácido-base de una manera donde el protón H + debe estar involucrado. Los ácidos de Lewis y las bases de Lewis se definen de una manera más inclusiva que fue introducida por primera vez por G. N. Lewis en 1923.
Ácido de Lewis: una especie que puede aceptar un par de electrones;
Base Lewis: una especie que puede donar un par de electrones.
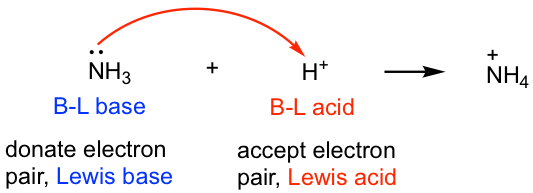
Todos los ácidos y bases de Brønsted-Lowry encajan en la definición de Lewis, porque el proceso de transferencia de protones es esencialmente la reacción donde la base utiliza su par de electrones para aceptar un protón, como lo indica la flecha del mecanismo que aprendimos anteriormente. Por lo tanto, en la siguiente reacción, el ácido BL, H +, es también el ácido de Lewis, y la base BL, NH 3, también se ajusta a la definición de la base de Lewis.
Sin embargo, la definición de Lewis es más amplia y abarca más situaciones. Para la siguiente reacción, B (CH 3) 3 es el ácido de Lewis porque el boro tiene un octeto incompleto, y el orbital 2p vacío sobre boro es capaz de aceptar electrones. (CH 3) 3 N se comporta como la base de Lewis con el electrón de par solitario en N que es capaz de ser donado.
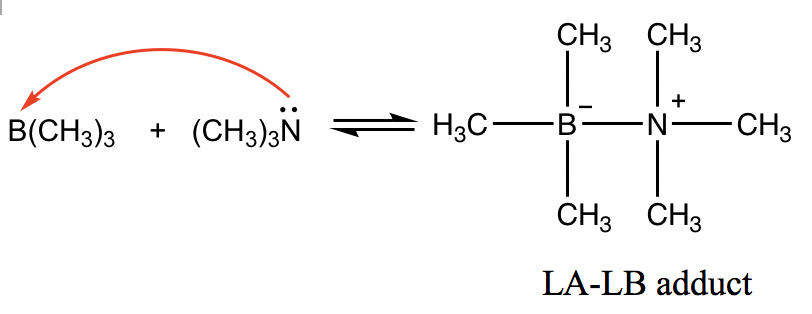
El producto entre los ácidos de Lewis y las bases de Lewis suele ser una especie que tiene el ácido y la base unidos entre sí, y el producto se llama el “aducto LA-LB”.
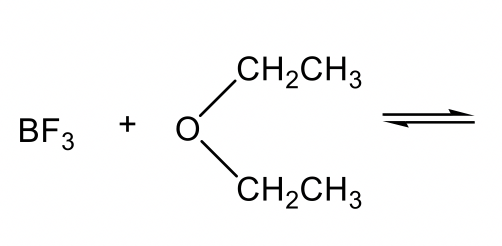
Otros ejemplos de ácidos de Lewis incluyen especies deficientes en electrones, tales como H +, M +, M 2+, BH 3, BF 3, AlCl 3 etc. Las bases de Lewis pueden ser: amina, éter u otras especies que tengan electrones de pares solitarios para donar.
Ejercicios 3.3