3.4: Efectos estructurales sobre la acidez y basicidad
- Page ID
- 76357
Hemos aprendido que diferentes grupos funcionales tienen diferentes fortalezas en términos de acidez. En esta sección, obtendremos una comprensión de las razones fundamentales detrás de esto, razón por la cual un grupo es más ácido que el otro. Muchos de los conceptos que aprenderemos aquí seguirán aplicándose a lo largo de este curso ya que abordamos muchos otros temas orgánicos.
3.4.1 Efecto Elemento
A. Tendencia periódica: Electronegatividad
El efecto del elemento es sobre el individuo en om que se conecta con el hidrógeno (tenga en cuenta que la acidez se trata de la capacidad de donar un cierto hidrógeno). Comparemos la acidez de los hidrógenos en etano, metilamina y etanol como se muestra a continuación.
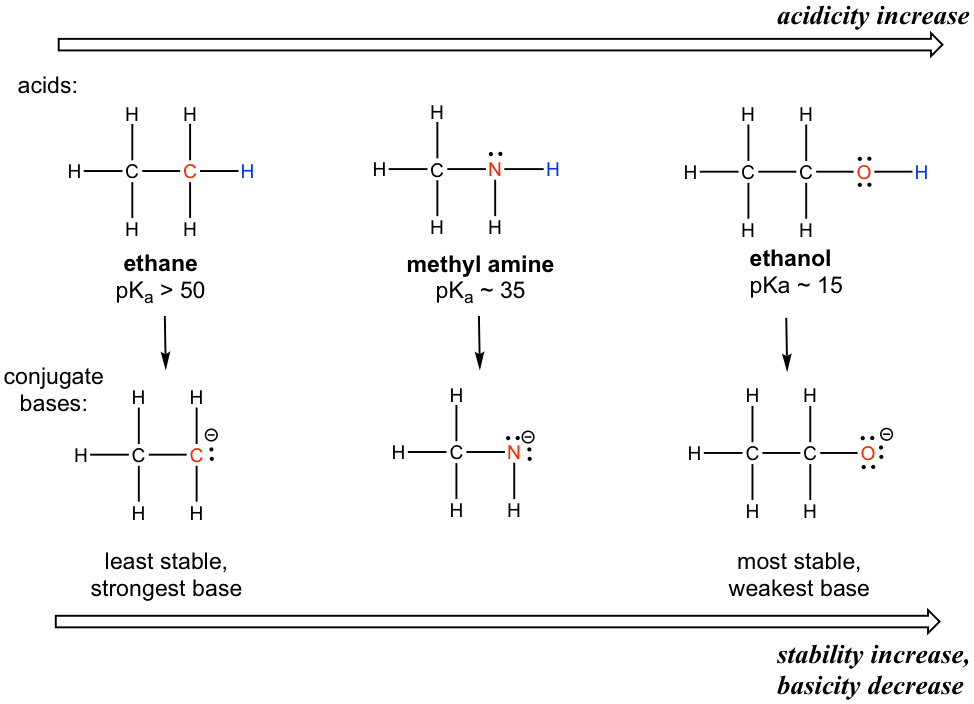
Una clara tendencia en la acidez de estos compuestos es: la acidez aumenta para los elementos de izquierda a derecha a lo largo de la segunda fila de la tabla periódica, C a N, y luego a O. Esto es consistente con la tendencia creciente de electronegatividad a lo largo del periodo de izquierda a derecha. La conexión entre electronegatividad y acidez puede explicarse como el átomo con una electronegatividad mayor siendo capaz de acomodar mejor la carga negativa de la base conjugada, estabilizando así la base conjugada de una mejor manera. Por lo tanto, cuanto más estable es la base conjugada, más débil es la base conjugada y más fuerte es el ácido. Para las discusiones en esta sección, la tendencia en la estabilidad (o basicidad) de las bases conjugadas a menudo ayuda a explicar la tendencia de la acidez.
La acidez relativa de los elementos en el mismo periodo es:
Para los elementos del mismo periodo, cuanto más electronegativo sea un átomo, más fuerte es el ácido; la acidez aumenta de izquierda a derecha a lo largo del periodo.
B. Tendencia del grupo (vertical): Tamaño del átomo
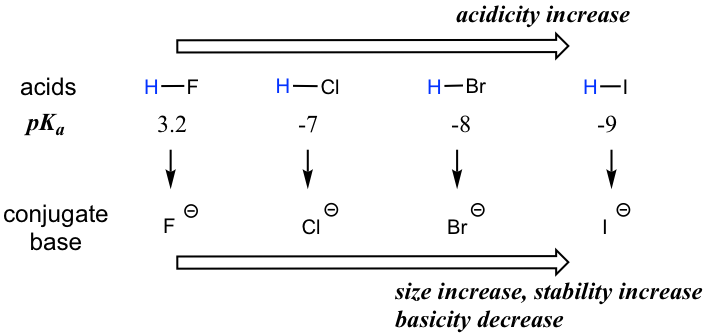
Al moverse verticalmente dentro de un grupo dado en la tabla periódica, la tendencia es que la acidez aumente de arriba a abajo. Esto se puede ilustrar con los haloácidos HX y haluros como se muestra a continuación: la acidez de HX aumenta de arriba a abajo, y la basicidad de las bases conjugadas X — disminuye de arriba a abajo.
La acidez del grupo H en el tiol SH también es más fuerte que el grupo alcohol OH correspondiente, siguiendo la misma tendencia. Por ejemplo, el p K a de CH 3 CH 2 SH es ~10, que es mucho más ácido que el etanol CH 3 CH 2 OH con un p K a de ~16.
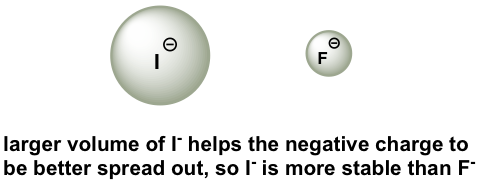
Para darle sentido a esta tendencia, volveremos a considerar la estabilidad de las bases conjugadas. Al moverse verticalmente en el mismo grupo de la tabla periódica, el tamaño del átomo anula su electronegatividad con respecto a la basicidad. El radio atómico del yodo es aproximadamente el doble que el del flúor, por lo que en un ion yoduro, la carga negativa se extiende sobre un volumen significativamente mayor, por lo que I — es más estable y menos básico, haciendo que el HI sea más ácido.
La acidez relativa de los elementos del mismo grupo es:
Para los elementos del mismo grupo, cuanto mayor sea el tamaño del átomo, más fuerte es el ácido; la acidez aumenta de arriba a abajo a lo largo del grupo.
3.4.2. Efecto de Resonancia
El efecto de resonancia explica la diferencia de acidez entre etanol y ácido acético. Tanto para el etanol como para el ácido acético, el hidrógeno está unido con el átomo de oxígeno, por lo que no hay ningún efecto de elemento que importe. Sin embargo, los valores p K a (y la acidez) del etanol y el ácido acético son muy diferentes. ¿Qué hace que un ácido carboxílico sea mucho más ácido que un alcohol? Como se indicó anteriormente, comenzamos por considerar la estabilidad de las bases conjugadas, recordando que una base conjugada más estable (más débil) corresponde a un ácido más fuerte.
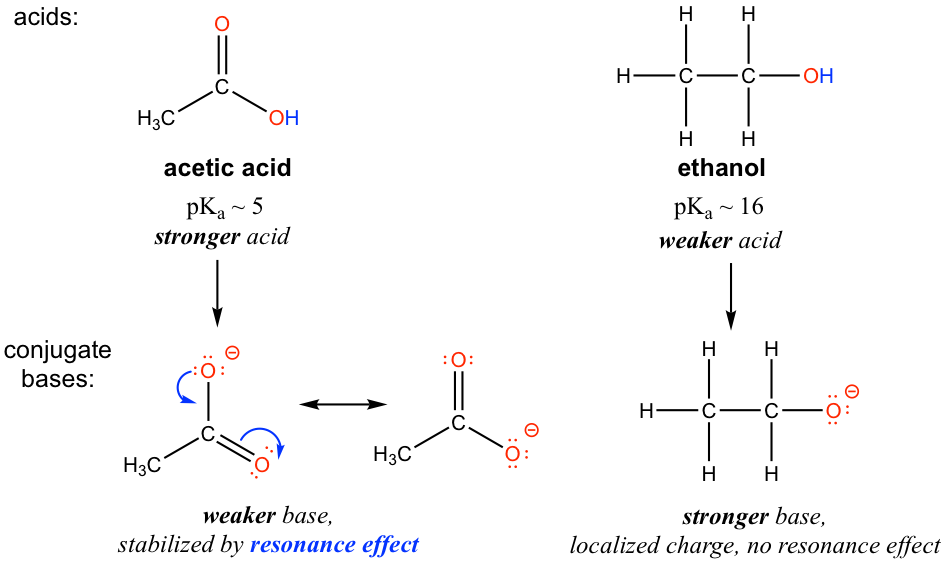
Para el acetato, la base conjugada del ácido acético, se pueden extraer dos contribuyentes de resonancia y por lo tanto la carga negativa se puede deslocalizar (compartir) sobre dos átomos de oxígeno. Sin embargo, no hay otro contribuyente de resonancia disponible en el ion etóxido, la base conjugada del etanol, por lo que la carga negativa se localiza en el átomo de oxígeno. Como hemos aprendido en la sección 1.3, la especie que tiene más contribuyentes de resonancia gana estabilidad, por lo tanto el acetato es más estable que el etóxido, y es más débil como base, por lo que el ácido acético es un ácido más fuerte que el etanol.
La deslocalización de carga por resonancia tiene un efecto muy poderoso sobre la reactividad de las moléculas orgánicas, suficiente para explicar la gran diferencia de más de 10 unidades p K a entre etanol y ácido acético. Porque p K a = —log K a, eso significa que hay un factor de aproximadamente 10 10 entre los valores de K a para las dos moléculas!
Ejemplos
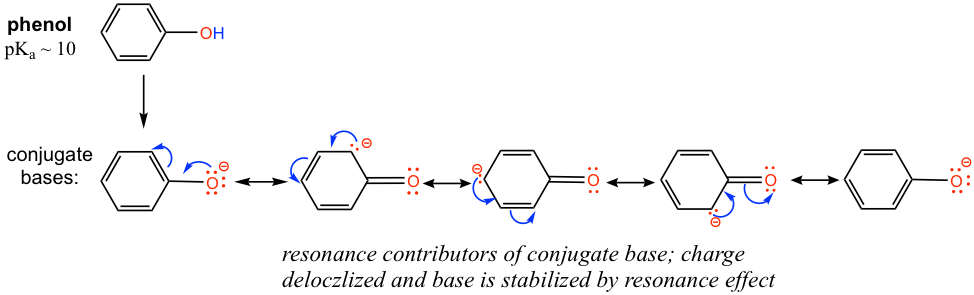
El p K a del grupo OH en alcohol es aproximadamente 15, sin embargo OH en fenol (grupo OH conectado en un anillo de benceno) tiene un pK a de aproximadamente 10, que es mucho más fuerte en acidez que otros alcoholes. Explique la diferencia.

Solución:
La diferencia puede explicarse por el efecto de resonancia. No hay efecto de resonancia sobre la base conjugada del etanol, como se mencionó anteriormente. Sin embargo, la base conjugada del fenol se estabiliza por el efecto de resonancia con cuatro contribuyentes de resonancia más, y el negativo se deslocaliza en el anillo de benceno, por lo que la base conjugada del fenol es mucho más estable y es una base más débil. Por lo tanto, el fenol es mucho más ácido que otros alcoholes.
Ejercicios 3.2
- ¡Practica dibujar las estructuras de resonancia de la base conjugada del fenol por ti mismo!
- Es por la especial acidez del fenol (y otros alcoholes aromáticos), que el NaOH se puede utilizar para desprotonar el fenol de manera efectiva, pero no a alcoholes normales, como el etanol. Mostrar las ecuaciones de reacción de estas reacciones y explicar la diferencia aplicando los valores p K a.
3.4.3 Efecto Inductivo
Comparemos los valores p K a del ácido acético y sus derivados mono-, di- y tri-clorados:
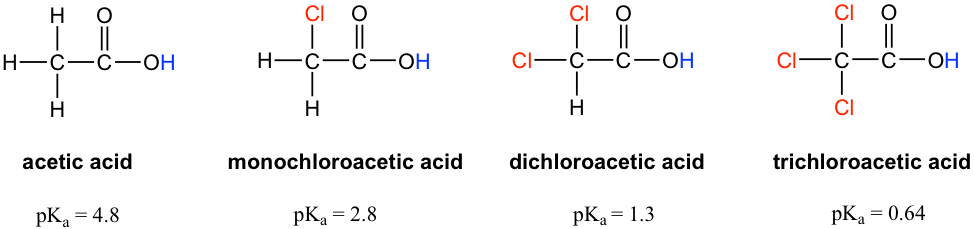
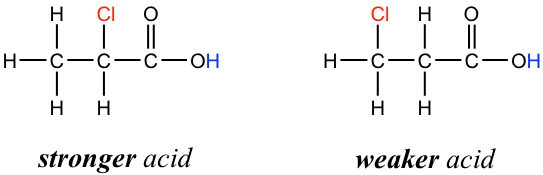
La presencia de los átomos de cloro aumenta claramente la acidez del grupo ácido carboxílico, y el argumento aquí aparentemente no tiene que ver con el efecto elemento. El efecto de resonancia tampoco tiene que ver con ello, ya que no se pueden dibujar contribuyentes de resonancia adicionales para las moléculas cloradas. Más bien, la explicación de este fenómeno implica algo llamado efecto inductivo. Un átomo de cloro es más electronegativo que el hidrógeno, y por lo tanto es capaz de 'inducir', o 'tirar' la densidad de electrones hacia sí mismo a través de enlaces σ en el medio, y por lo tanto ayuda a extender la densidad electrónica de la base conjugada, el carboxilato, y estabilizarla. El sustituyente cloro puede denominarse un grupo aceptor de electrones debido al efecto inductivo.
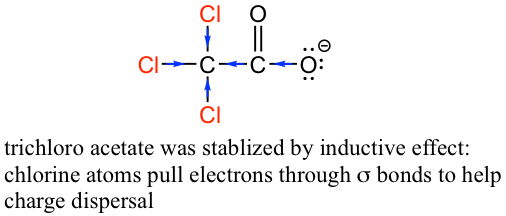
El efecto inductivo es el efecto de dispersión de carga de los átomos electronegativos a través de enlaces σ. El efecto inductivo es adictivo; más átomos de cloro tienen un efecto general más fuerte, lo que explica el aumento de la acidez del ácido acético mono, a di-, a tri-clorado. El siguiente diagrama muestra como ejemplo el efecto inductivo del acetato de tricloro.
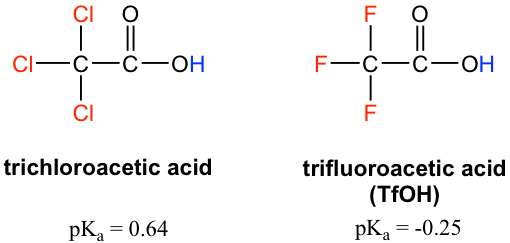
Debido a que el efecto inductivo depende de la electronegatividad, los sustituyentes flúor tienen un efecto inductivo más fuerte que los sustituyentes cloro, haciendo del ácido trifluoroacético (TFA) un ácido orgánico muy fuerte.
Además, debido a que el efecto inductivo se produce a través de enlaces covalentes, su influencia disminuye significativamente con la distancia, por lo que un cloro que está a dos carbonos de un grupo ácido carboxílico tiene un efecto más débil en comparación con un cloro a solo un carbono de distancia.
3.4.4 Efecto de Hibridación
Para introducir el efecto de hibridación, analizaremos la diferencia de acidez entre alcano, alqueno y alquino.
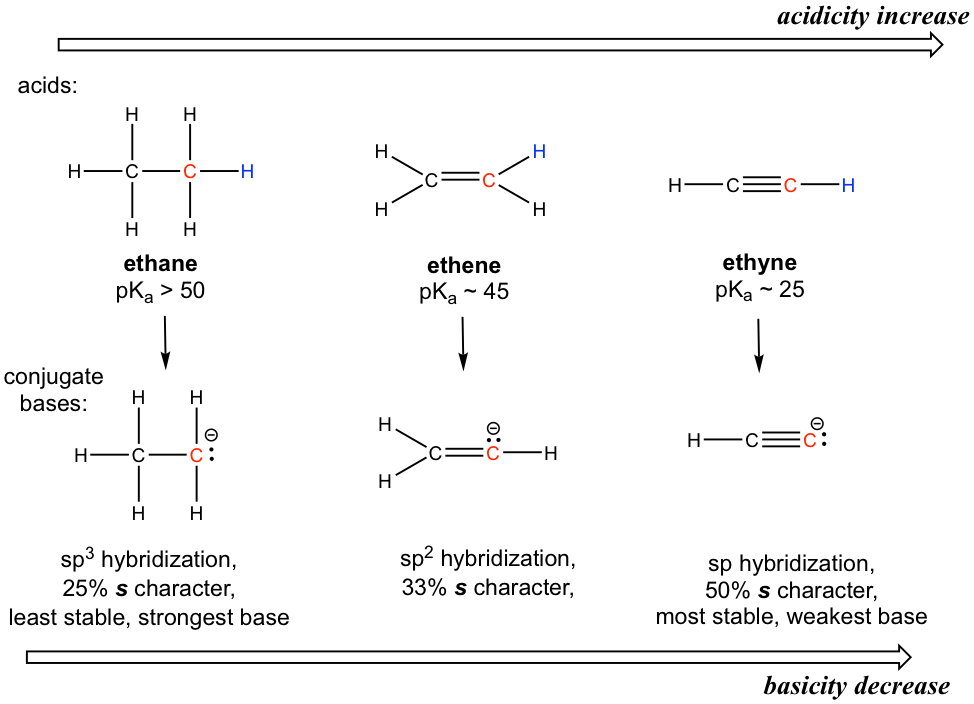
El átomo de hidrógeno está unido con un átomo de carbono en los tres grupos funcionales, por lo que el efecto elemento no invoca. También considerando acerca de la base conjugada de cada uno, no hay un contribuyente de resonancia extra posible.
La diferencia clave entre los aniones base conjugada es la hibridación del átomo de carbono, es decir sp 3, sp 2 y sp respectivamente para alcano, alqueno y alquino. Diferentes hibridaciones conducen a diferentes caracteres s, es decir, el porcentaje de orbitales s sobre la cantidad total de orbitales. La hibridación sp 3 significa 25% de carácter s (uno s y tres orbitales p, por lo que el carácter s es 1/4 = 25%), la hibridación sp 2 tiene 33.3% de carácter s, y el número es de 50% para la hibridación sp. Los electrones de los orbitales de 2 s están en el nivel de energía más bajo que los de los orbitales de 2 p porque 2 s está mucho más cerca del núcleo. Entonces para el anión con más carácter s, los electrones están más cerca del núcleo y experimentan una atracción más fuerte, por lo tanto el anión tiene menor energía y es más estable.
La estabilidad relativa de los tres aniones (bases conjugadas) también se puede ilustrar mediante el mapa de potencial electrostático, en el que el color más claro (menos rojo) indica menor densidad de electrones del anión, y la mayor estabilidad.
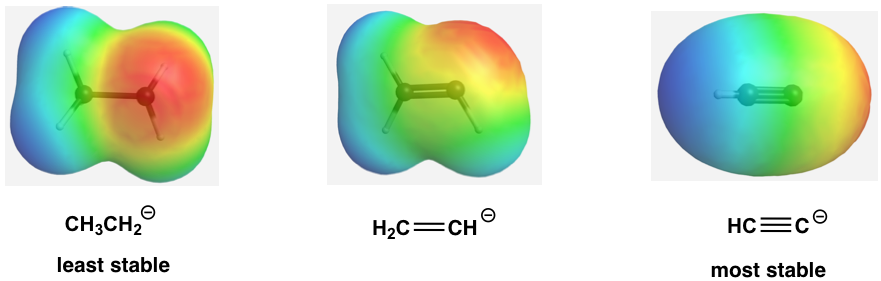
Esto también se puede afirmar de manera más general que más carácter s en los orbitales híbridos hacen que el átomo sea más electronegativo. Para el mismo átomo, un átomo hibridado sp es más electronegativo que el átomo hibridado sp 2, el cual es más electronegativo que el átomo hibridado sp 3.


