4.1: Análisis de conformación de alcanos
- Page ID
- 76316
4.1.1 Conformación
A nivel molecular, una propiedad de los enlaces σ (sigma) en alcano es que los enlaces siguen girando. Para el ejemplo del etano (CH 3 CH 3), un grupo metilo (CH 3) es capaz de rotar alrededor del enlace C-C libremente sin ningún obstáculo.
Es muy recomendable que el modelo molecular se utilice aquí para “ver” la rotación del enlace. Con un modelo molecular a mano, puede mantener estable un grupo metilo y rotar el otro grupo metilo.El enlace C-C está formado por los orbitales sp 3 -sp 3 solapados y el enlace es simétrico de forma cilíndrica, por lo que la rotación alrededor del enlace puede ocurrir fácilmente y la molécula no parece cambiar. Sin embargo, una mirada más cercana indica que la rotación del enlace C-C da como resultado una disposición espacial diferente de los átomos de hidrógeno en la molécula, como se muestra a continuación:
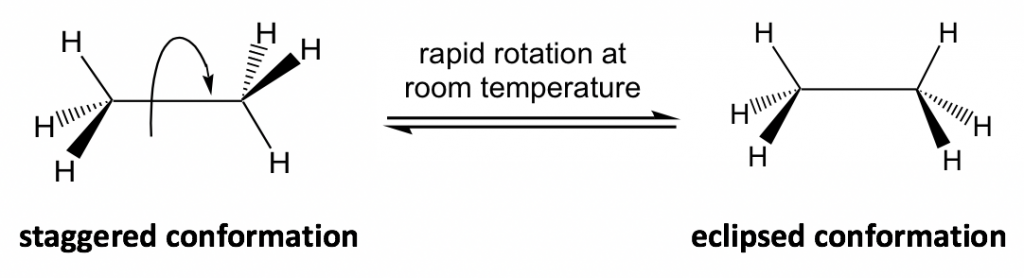
Las diferentes disposiciones espaciales de los átomos/grupos que resultan de la rotación del enlace simple se denominan conformaciones. Las moléculas con diferentes conformaciones se denominan isómeros conformacionales o confórmeros. Las dos conformaciones extremas de etano provenientes de la rotación C-C que se muestran anteriormente son: la conformación escalonada con todos los átomos de H extendidos y la conformación eclipsada con todos los átomos de H solapados.
En el estudio de la conformación, es conveniente utilizar ciertos tipos de fórmulas estructurales. La fórmula utilizada en el dibujo anterior es la fórmula en perspectiva (ver sección 2.1.1) que muestra la vista lateral de la molécula. En fórmulas de perspectiva, se utilizan cuñas sólidas y discontinuas para mostrar la disposición espacial de los átomos (o grupos) alrededor de los carbonos sp 3.
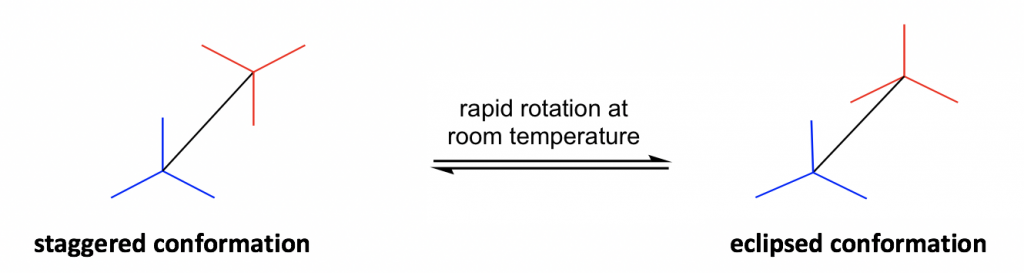
Otra fórmula estructural es la fórmula de caballete que muestra la vista superior inclinada de la molécula.
La fórmula más comúnmente aplicada en el análisis de conformación es la fórmula de proyección de Newman.
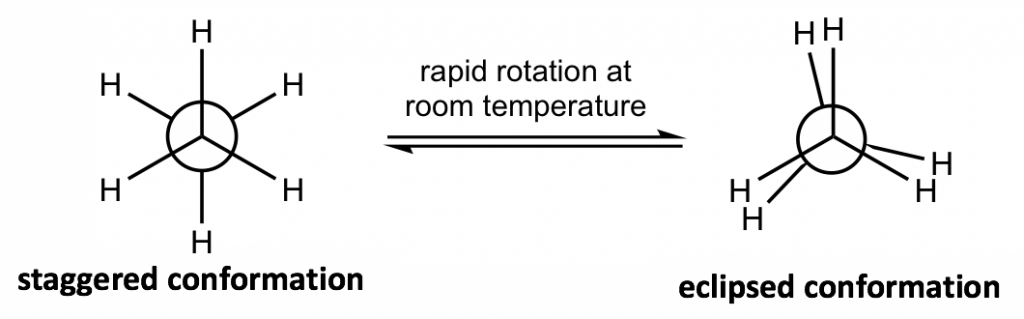
Cómo dibujar una proyección de Newman
Para dibujar una proyección de Newman, imaginaremos ver la molécula de un carbono al siguiente átomo de carbono directamente a lo largo de un enlace C — C seleccionado, como se muestra a continuación, y seguir las reglas:
- El átomo de carbono frontal se muestra como un punto con otros tres enlaces:
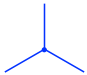
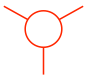
- El átomo de carbono posterior se muestra como un círculo con otros tres enlaces:
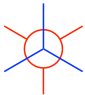
- Junte los dos carbonos para obtener la proyección Newman de la conformación escalonada:
- Desde la conformación escalonada, fije el carbono delantero en su lugar y gire el carbono trasero 60° para obtener la conformación eclipsada:
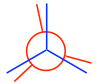
Nota: En confórmeros eclipsados, se supone que los enlaces C-H se completan superpuestos; sin embargo, para hacer que los grupos traseros aún sean visibles, los enlaces en el carbono trasero se dibujan intencionalmente ligeramente inclinados .
4.1.2 Análisis de conformación de etano
A continuación, haremos un análisis de conformación del etano utilizando las proyecciones de Newman. Un análisis de co-formación es una investigación de las diferencias de energía y estabilidades relativas de las diferentes conformaciones de un compuesto.
Las dos conformaciones de etano, escalonadas y eclipsadas, son diferentes y por lo tanto deben estar en diferentes niveles de energía. También puede predecir intuitivamente que la conformación escalonada es más estable y es de menor energía, porque los enlaces C-H están dispuestos lo más separados posible en esa conformación. ¡Eso es correcto! En conformaciones eclipsadas, los átomos de H en el carbono frontal se superponen con los átomos H en el carbono posterior, y esta disposición provoca la repulsión entre los electrones de los enlaces C-H de los dos carbonos. Este tipo de repulsión se llama la tensión torsional, también conocida como la cepa eclipsante. Debido a la deformación torsional, el conformador eclipsado está en el nivel de energía que es 12 kJ/mol (o aproximadamente 2.9 kcal/mol) mayor que el escalonado. Esto se puede representar gráficamente en un diagrama de energía potencial como se muestra en la Figura 4.1f.
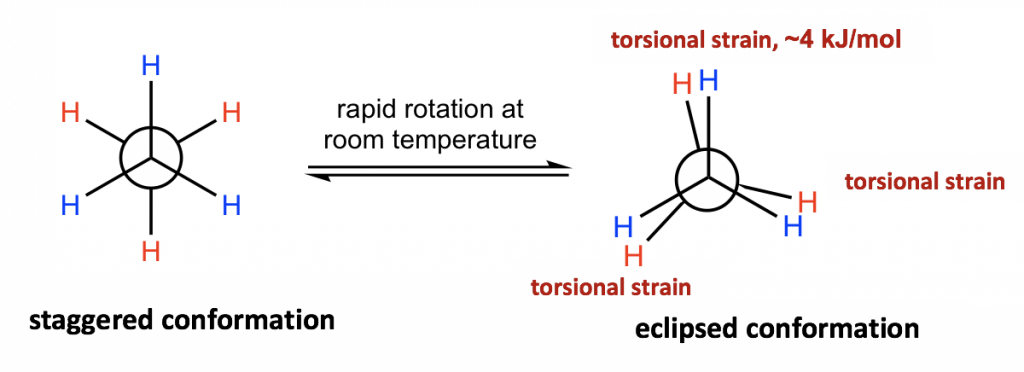
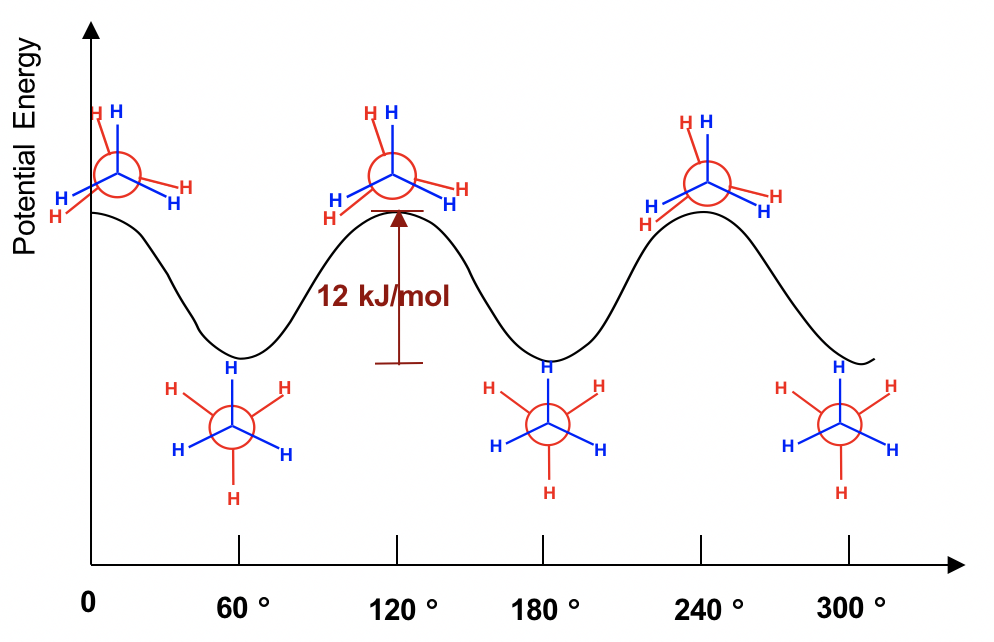
Debido a esta diferencia de energía, se debe superar una barrera de energía cuando se produce la rotación alrededor del enlace C-C. Sin embargo, esta diferencia de energía en etano es bastante pequeña, y la energía cinética de las moléculas a temperatura ambiente es lo suficientemente alta como para cubrirlo. Entonces, a temperatura ambiente, los cambios de conformadores escalonados a eclipsados ocurren millones de veces por segundo. Debido a estas interconversiones continuas, estos dos confórmeros no pueden separarse entre sí. Sin embargo, en cualquier momento dado, alrededor del 99% de las moléculas de etano estarán en una conformación escalonada debido a su mayor estabilidad.
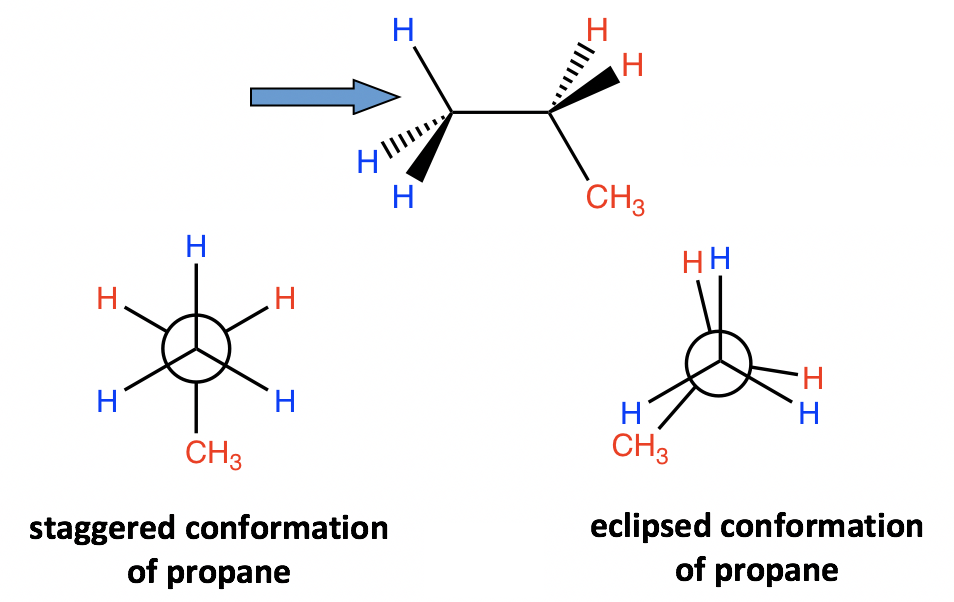
4.1.3 Análisis de Conformación de Propano
También se puede aplicar un análisis similar al propano. Encontraremos que todavía hay dos tipos de conformaciones, escalonadas y eclipsadas, resultantes de la rotación. La diferencia entre propano y etano es que hay un grupo metilo (CH 3) conectado en la parte trasera de carbono para propano. Sin embargo, eso no afecta la estabilidad relativa, y el conformador escalonado es más estable y en menor energía.
4.1.4 Análisis de Conformación de Butano
Hay tres enlaces C-C en el butano, y la rotación puede ocurrir alrededor de cada uno de ellos. Si recogemos C1-C2 (o C3-C4) para el estudio, la situación es casi la misma que el propano, con el grupo etilo CH 2 CH 3 reemplazamos al grupo CH 3. No obstante, si consideramos la rotación sobre el bono C2-C3, la situación será mucho más compleja.
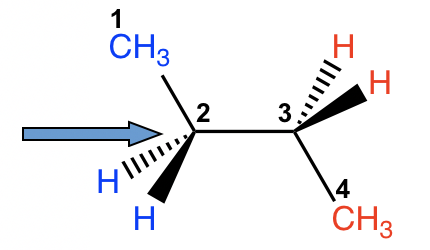
Para ambos átomos de carbono, C2 y C3, hay dos átomos de hidrógeno y un grupo metilo CH 3 unidos con. Podemos comenzar con el conformador en el que los dos grupos CH 3 son opuestos entre sí, luego fijar el carbono delantero y hacer rotaciones de 60° del carbono trasero para investigar todas las conformaciones posibles.
Ejercicios 4.1: Dibujar todos los posibles conformadores de butano desde la visualización a lo largo del enlace C2-C3. ¡Termina esta práctica por ti mismo antes de continuar leyendo!
Consejos para dibujar todos los conformadores posibles sobre un cierto enlace C-C:
- Ver a lo largo de ese enlace C-C; círculo y decidir qué átomos/grupos están conectados en cada carbono;
- Empezar con la conformación escalonada en la que los grupos más grandes de cada carbono son opuestos (muy lejos) entre sí (esto se llama la conformación “anti” como aprenderemos más adelante);
- Mantenga los grupos en un carbono “fijos” y rote los grupos en el otro carbono en ángulos de 60°. Repite la rotación cinco veces, y deberías obtener un total de seis conformadores.
Respuestas a las preguntas de práctica Capítulo 4
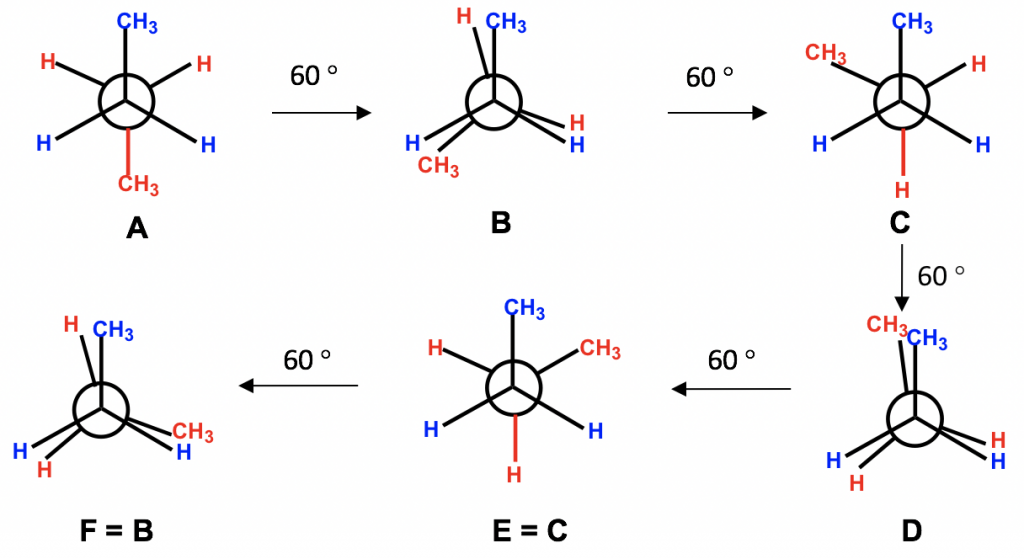
Entre los seis confórmeros obtenidos, hay tres escalonados y tres eclipsados. Las conformaciones escalonadas C y E deben estar en el mismo nivel de energía porque los grupos están dispuestos de manera equivalente entre estos dos conformadores. De igual manera, las conformaciones eclipsadas F y B también están en el mismo nivel de energía. Por lo que nuestros estudios pueden enfocarse en los cuatro conformadores, A, B, C y D, que son diferentes en términos de energía y estabilidad.
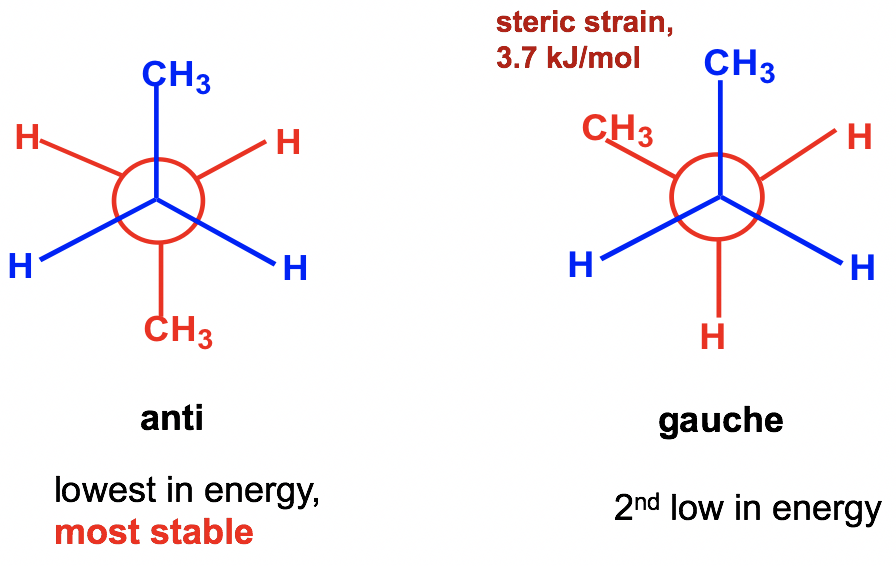
Entre los dos conformadores escalonados A y C, A es más estable que C porque los dos grupos metilo CH 3 en A están lo más separados posible. Esta conformación escalonada más estable se llama anti conformación (anti es griego para “opuesto”). En anti conformaciones, los grupos más grandes en el carbono delantero y trasero son 180° opuestos entre sí. La otra conformación escalonada C se denomina conformación gauche, en la que los dos grandes grupos son adyacentes y están a 60° entre sí. Con los grupos grandes cerca uno del otro en confórmeros gauche, la molécula experimenta una cepa estérica. La cepa estérica es la cepa que se produce cuando los átomos (o grupos) están lo suficientemente cerca entre sí como para que sus nubes de electrones se repelan entre sí. La cepa estérica solo importa cuando los grupos están cerca entre sí (menores o iguales a 60°), por lo que la cepa estérica no se aplica en anti conformaciones. La magnitud de la cepa estérica también depende del tamaño del grupo; cuanto mayor sea el tamaño, mayor será la cepa estérica. Como resultado, no hay tensión estérica entre dos pequeños átomos de hidrógeno, aunque estén cerca uno del otro.
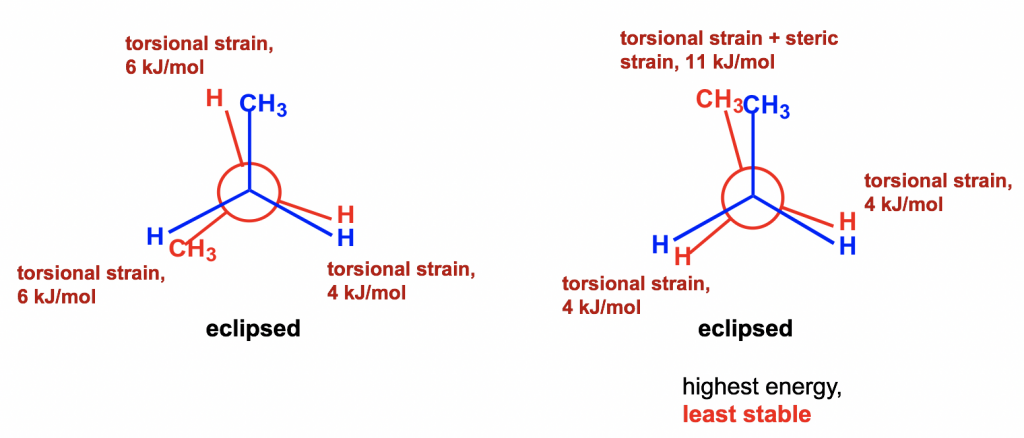
Entre los dos confórmeros eclipsados B y D , D es menos estable que B, porque los dos grupos CH 3 son eclipsándose (superponiéndose) entre sí en D, causando cepas tanto torsionales como estéricas.
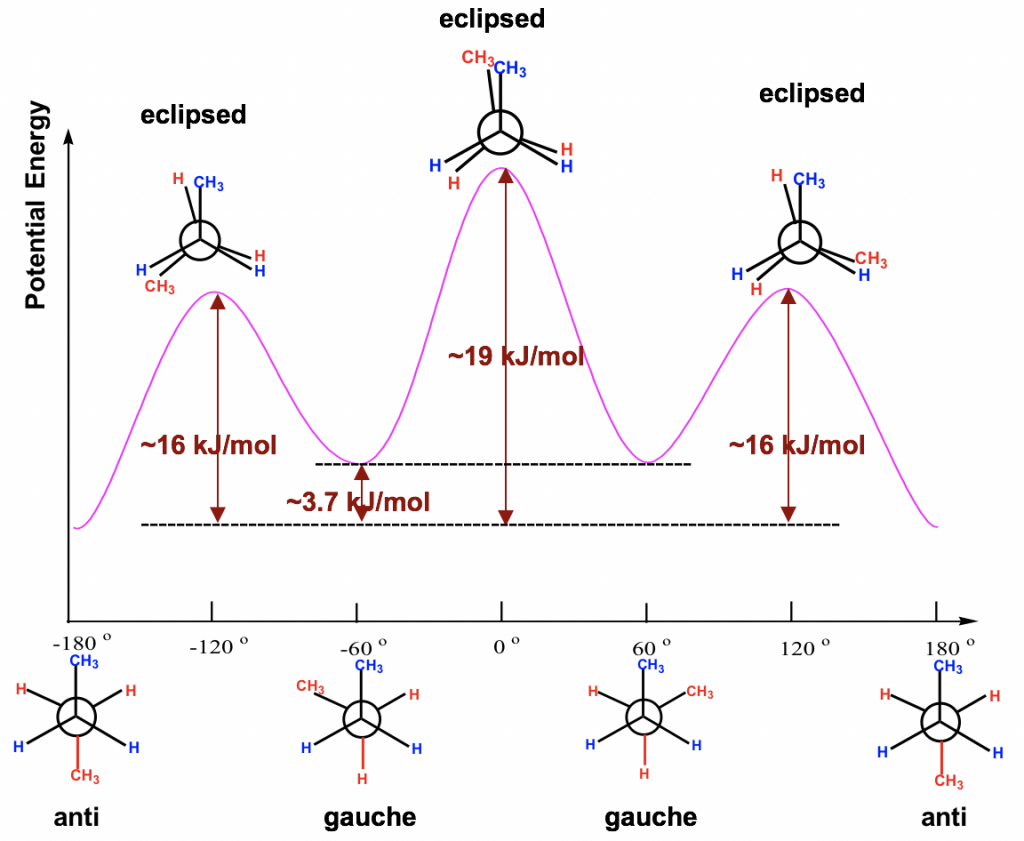
La diferencia de energía de todos los conformadores obtenidos de la rotación alrededor del enlace C2-C3 se muestran en el diagrama de energía potencial Fig. 4.1l. La curva es más compleja que la del etano ya que existen cuatro niveles de energía diferentes correspondientes a cuatro conformadores con diferentes estabilidades. Incluso las barreras energéticas para las rotaciones son mayores que las del etano, pero aún no son lo suficientemente altas como para detener la rotación a temperatura ambiente.
Ejercicios 4.2
Dibuje todos los confórmeros para 3-metilpentano viendo a lo largo del enlace C2-C3, y ordenarlos del más estable al menos estable.


