4.2: Cicloalcanos y sus estabilidades relativas
- Page ID
- 76325
Si bien los alcanos de cadena abierta tienen isómeros conformacionales debido a la rotación de enlaces, ¿esto se aplicará también a los cicloalcanos? En esta sección, primero analizaremos las propiedades de los cicloalcanos, y luego investigaremos cómo los diferentes confórmeros de los cicloalcanos contribuyen a las diferentes estabilidades.
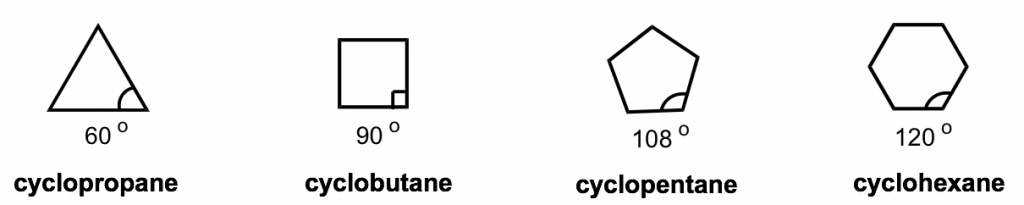
Las fórmulas estructurales de línea corta de los cicloalquenos simplemente parecen formas como un triángulo, cuadrado etc. Los ángulos internos de las formas se pueden calcular con geometría, como se muestra a continuación.
Un dato interesante sobre los cicloalcanos es que tienen diferentes estabilidades relativas, y la estabilidad depende del tamaño del anillo. Se ha observado que los compuestos cíclicos que se encuentran en la naturaleza generalmente se encuentran en anillos de 5 o 6 miembros, y los anillos de 3 o 4 miembros son bastante raros.
Para explicar esta diferencia de estabilidad, el químico alemán Adolf von Baeyer propuso la “Teoría de la Cepa de Bayer”. Al asumir que todos los anillos están en forma plana (o plana), Bayer Theory sugiere que la diferencia entre el ángulo de unión ideal (que es de 109.5° para el carbono sp 3) y el ángulo en el cicloalcano cepillador causa la deformación, que se llama ang le strain. Según la Teoría de Bayer, el ciclopentano sería el más estable porque sus ángulos de unión, 108°, son los más cercanos al ángulo ideal de 109.5°. El ciclopropano sería el menos estable ya que tiene la mayor desviación angular de 49.5° (60° vs 109.5°). También se predijo que el ciclohexano sería menos estable que el ciclopentano debido a la mayor desviación angular (desviación de 10.5° para ciclohexano vs 1.5° para ciclopentano), y a medida que el número de lados en los cicloalcanos aumenta más allá de seis, la estabilidad disminuiría.
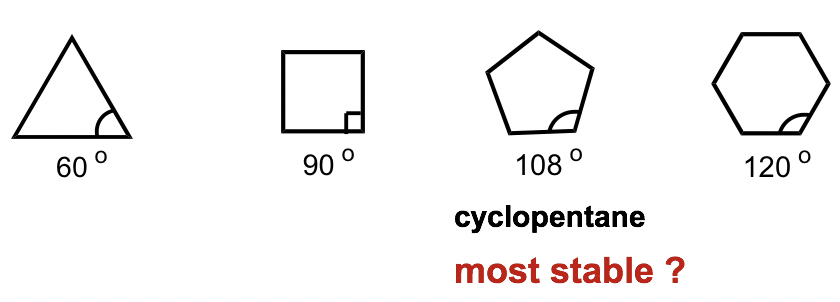
Sin embargo, los resultados experimentales muestran una tendencia diferente. Resulta que el ciclohexano es el anillo más estable que está libre de tensión, y es tan estable como un alcano de cadena. Además, los compuestos cíclicos no se vuelven cada vez menos estables a medida que aumenta el número de anillos.
Para medir la estabilidad relativa de los cicloalcanos, se midió el calor de combustión (ΔH comb) para cada cicloalcano. El calor de combustión es la cantidad de calor liberado cuando los compuestos se queman completamente con oxígeno. Los cicloalcanos estarán en niveles de energía más altos que los alcanos de cadena correspondientes debido a la energía de tensión. Por lo tanto, cuando el cicloalcano se quema, se liberará más calor, por lo que la diferencia del peine ΔH entre el cicloalcano frente al alcano de cadena “sin tensión” es solo la cantidad de energía de tensión, como se muestra a continuación. Cuanto mayor sea la diferencia, mayor será la energía de deformación del cicloalcano. La energía de deformación para diferentes cicloalcanos medidos por este método se enumeran en la Tabla 4.1.
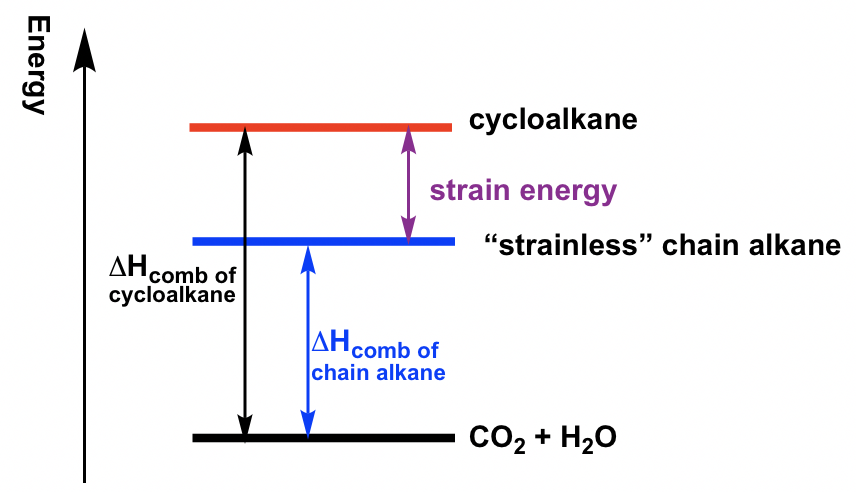
| ciclopropano | ciclobutano | ciclopentano | ciclohexano | |
| Energía de tensión (kJ/mol) | 114 | 110 | 25 | 0 |
Tabla 4.1 Energías de cepa de cicloalcanos
El mayor inconveniente de la Teoría Baeyer fue que debemos asumir que todos los anillos son planos. La mayor estabilidad del ciclohexano a partir de los resultados experimentales indican que los anillos pueden no estar en una forma plana. Tendremos una mirada más cercana a la forma y conformación real de los cicloalcanos de 3, 4, 5 y 6 miembros.
Ciclopropano
Con tres carbonos para el anillo, el ciclopropano debe ser plano.
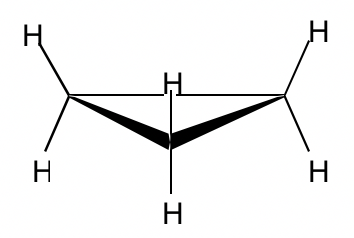
El ángulo de unión en ciclopropano es de 60°, derivado significativamente del ángulo óptimo de 109.5°, por lo que tiene deformaciones de ángulo muy altas. Los orbitales sp 3 -sp 3 solo pueden superponerse parcialmente debido a la desviación angular, por lo que el solapamiento no es tan efectivo como debería ser, y como resultado el enlace C-C en el ciclopropano es relativamente débil.

Debido a la mala superposición de los orbitales sp 3 -sp 3, los enlaces formados en el ciclopropano se asemejan a la forma de un plátano, y a veces se denominan enlaces de banano.

Aparte de las deformaciones angulares, todos los enlaces C-H adyacentes están eclipsados en ciclopropano, por lo que también se aplican las cepas torsionales. Tal cepa se puede “ver” más claramente a partir de la proyección Newman de ciclopropano.
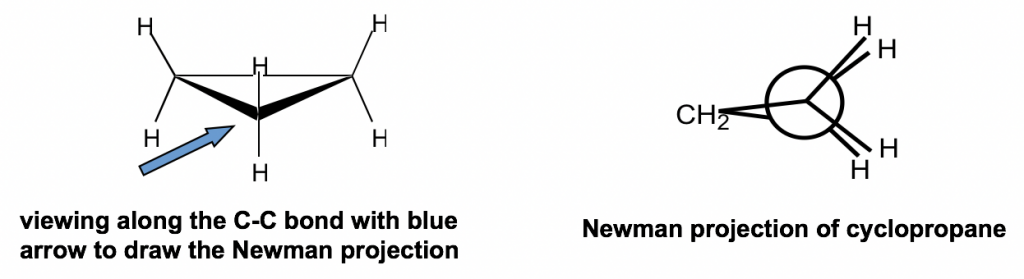
La proyección Newman del ciclopropano podría parecer rara a primera vista. Para el ciclopropano, hay tres carbonos, por lo que el grupo CH 2 se conecta con los carbonos delanteros y traseros de la proyección Newman.
Debido al alto nivel de deformaciones angulares y torsionales, los anillos de 3 miembros son inestables. Rara vez existen en la naturaleza y experimentan una reacción de apertura de anillo fácilmente para liberar las cepas.
Ciclobutano
El ciclobutano no es plano. El anillo frunce (o pliegues) ligeramente debido a los esfuerzos de liberar alguna tensión torsional. Mientras tanto, el ciclobutano todavía tiene una cantidad considerable de deformaciones angulares a medida que los ángulos internos se vuelven de aproximadamente 88° con la forma plegada. En general, el ciclobutano es una estructura inestable con un nivel bastante alto de cepas.

Ciclopentano
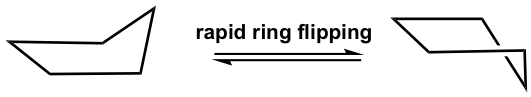
El ciclopentano tampoco es plano y el nivel total de tensión se baja bastante. También frunce y adopta una conformación doblada donde un átomo de carbono sobresale del plano de los otros, lo que ayuda a liberar la tensión torsional al permitir que algunos átomos de hidrógeno se vuelvan casi escalonados.
Esta forma doblada del ciclopentano también se llama conformación de “envoltura”. La conformación de la envolvente puede someterse a un proceso llamado “volteo de anillo” como resultado de la rotación del enlace C-C. Se incluirán más discusiones sobre el volteo de anillos en la sección de ciclohexano.