6.9: Práctica de Determinación de Estructura
- Page ID
- 76337
La RMN 1H proporciona una poderosa herramienta para determinar la estructura del compuesto desconocido. Aparte de eso RMN de 1H, la información adicional incluye la fórmula molecular, IR y espectro de RMN de 13 C generalmente se proporcionan también. Resolver la estructura de un compuesto desconocido basado en toda la información dada es un tipo importante de pregunta en la que trabajaremos para este capítulo. Tomaremos el ejemplo del isómero constitucional C 5 H 12 O para pasar por la estrategia para resolver este tipo de preguntas.
Las RMN 1H a continuación son todas para compuestos con fórmula molecular de C 5 H 12 O (el área de integración relativa para cada señal se da como números en los espectros). Los espectros IR de estos compuestos no tienen ninguna banda fuerte por encima de 3000 cm -1, ni hay bandas fuertes a 1700 cm -1. Proponer una estructura razonable para cada compuesto que sea consistente con los datos dados.
Enfoque:
Paso 1: Calcular el grado de instauración (o IHD, sección 2.3) con base en la fórmula molecular dada, y obtener pistas sobre estructura/grupo funcional de acuerdo con el grado de instauración. Este suele ser el primer paso para resolver este tipo de preguntas.
Grado de instauración =![]()
De lo que aprendimos sobre el grado de instauración, grado cero significa que no hay ningún anillo ni doble enlace en la estructura, es decir, todos los compuestos en esta cuestión tienen estructuras de cadena abierta con enlaces simples únicamente. Con un átomo de oxígeno involucrado, el posible grupo funcional será, por lo tanto, el alcohol de cadena abierta o el éter de cadena abierta.
Paso 2: Reduzca los posibles grupos funcionales con información IR.
IR indican que no hay bandas fuertes por encima de 3000 cm -1 para el compuesto, que excluyen la opción de alcohol, por lo que la única opción que queda es el éter de cadena abierta.
Paso 3: Usar los datos de espectroscopía disponibles (principalmente RMN 1H, con RMN de 13 C como soporte si está disponible) para identificar partes discretas de la estructura.
Paso 4: Intenta juntar las piezas del rompecabezas, y verifica dos veces si todo encaja con los datos disponibles.
Los pasos 3 y 4 son las partes más desafiantes ya que aquí no hay una regla simple a seguir sobre cómo hacerlo. Se necesitan prácticas para hacer la interpretación de las señales de RMN 1H y traducirlas en la estructura de compuesto desconocido. Comprobando los cuatro aspectos de 1H NMR tal y como aprendimos en la sección 6.6.5. Se dan las áreas relativas de integración para esta pregunta para que sea un poco más fácil.
Soluciones:
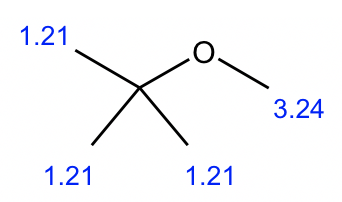
Compuesto 1:
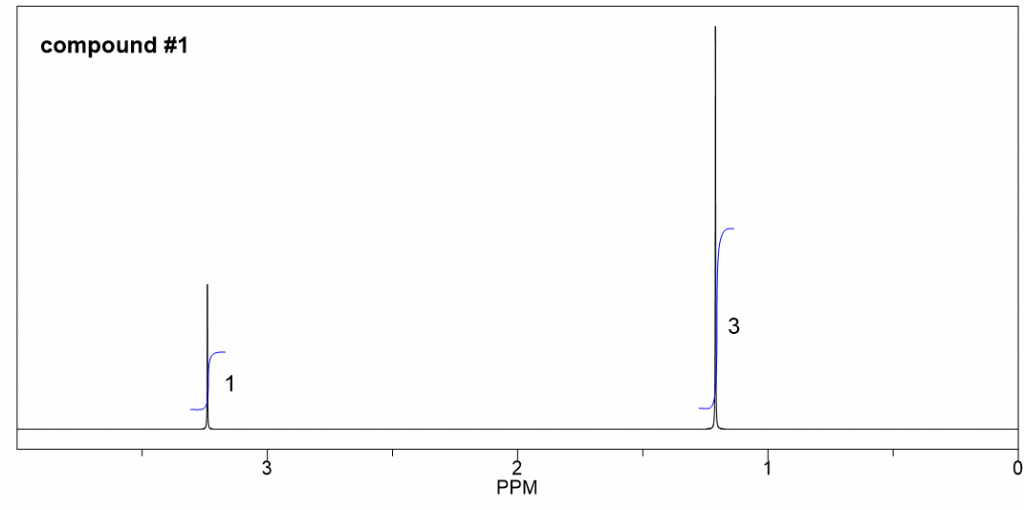
Podemos comenzar con el espectro más simple que tenga menos señales:
- Solo hay dos señales (ambas son singlete) en este espectro, indican que hay dos conjuntos de hidrógenos no equivalentes.
- Las integraciones de las dos señales son 3 y 1, significa que la relación del número de hidrógenos en estos dos conjuntos es 3:1. Y como hay un total de 12 hidrógenos, el número real de hidrógenos debe ser de 9 y 3 en cada grupo.
- 3 hidrógenos implican un grupo metilo CH 3, y 9 hidrógenos podrían ser tres grupos CH 3. También dado que todos los 9 hidrógenos son equivalentes, eso significa que los tres grupos CH 3 son equivalentes. La única manera de tener tres grupos CH 3 equivalentes es que hay un grupo t-butilo.
- Entonces la estructura es el éter con un grupo metilo y un grupo t-butilo conectado con el átomo de oxígeno.
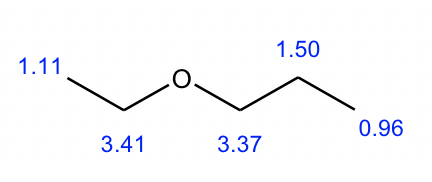
- La estructura del compuesto 1 se da a continuación, con el cambio químico valorado incluido.
Para los compuestos restantes, la integración para cada señal podría ser un muy buen punto de partida, ya que generalmente el valor de integración indica la posible unidad estructural como CH 3, CH 2 o CH. Entonces las unidades estructurales se pueden armar de una manera lógica como juntar piezas de un rompecabezas.
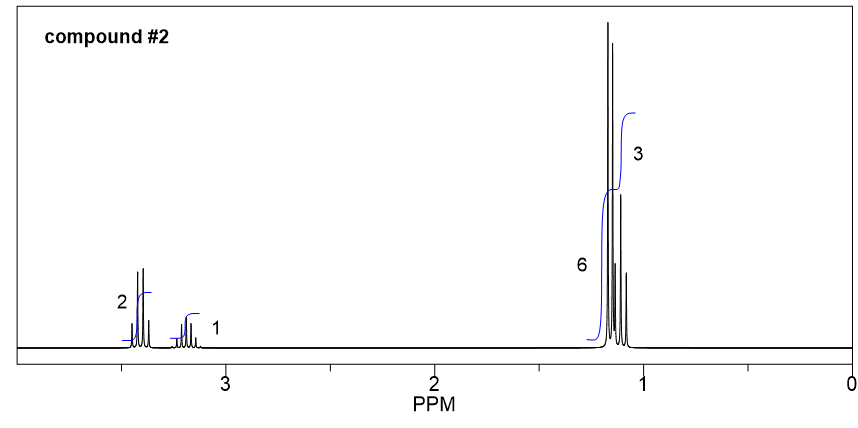
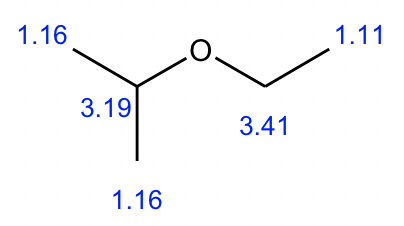
Compuesto 2:
- A partir de la integración, se determina que existen:
- un grupo CH 3 muestra un triplete;
- dos grupos CH 3 equivalentes muestran un doblete;
- un grupo CH muestra un multiplete;
- un grupo CH 2 muestra un cuarteto.
- El triplete CH 3 podría conectarse con el cuarteto CH 2 como un grupo etilo CH 2 CH 3, eso tiene sentido basado en el patrón de división.
- Además, los dos grupos CH 3 equivalentes con un CH podrían dar un grupo isopropilo, que es consistente con el patrón de división.
- Entonces la estructura general del compuesto 2 es éter isopropílico etílico.
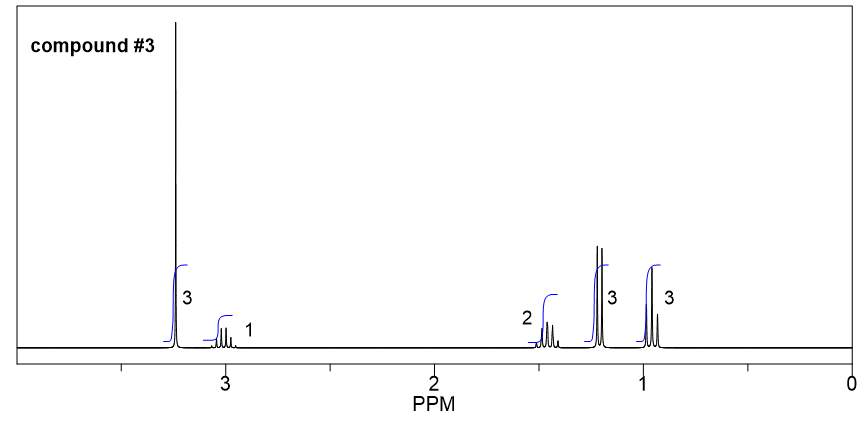
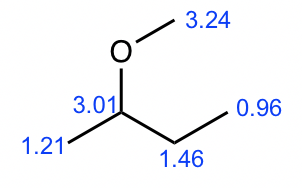
Compuesto 3:
- A partir de la integración, se determina que existen:
- un grupo CH 3 muestra un triplete;
- un grupo CH 3 muestran un doblete;
- un grupo CH 2 muestra un multiplete;
- un grupo CH muestra un cuarteto;
- un grupo CH 3 muestra una singlete.
- El singlete significa que el CH 3 no tiene ningún otro hidrógeno unido en átomos adyacentes, por lo que el grupo CH 3 debe estar unido con el átomo de oxígeno, y el valor del desplazamiento químico (aproximadamente 3.2 ppm) confirma.
- El triplete CH 3 podría conectarse con el cuarteto CH 2 como un grupo etilo CH 2 CH 3, eso tiene sentido basado en el patrón de división.
- Los grupos doblete CH 3 deben conectarse con un grupo CH, que es consistente con el patrón de división.
- El desplazamiento químico (aproximadamente 3 ppm) y la división del grupo CH (cuarteto) indican que debe conectarse al átomo de oxígeno.
- Juntar todas las piezas anteriores, la estructura del compuesto 3 es sec-butil metil éter.
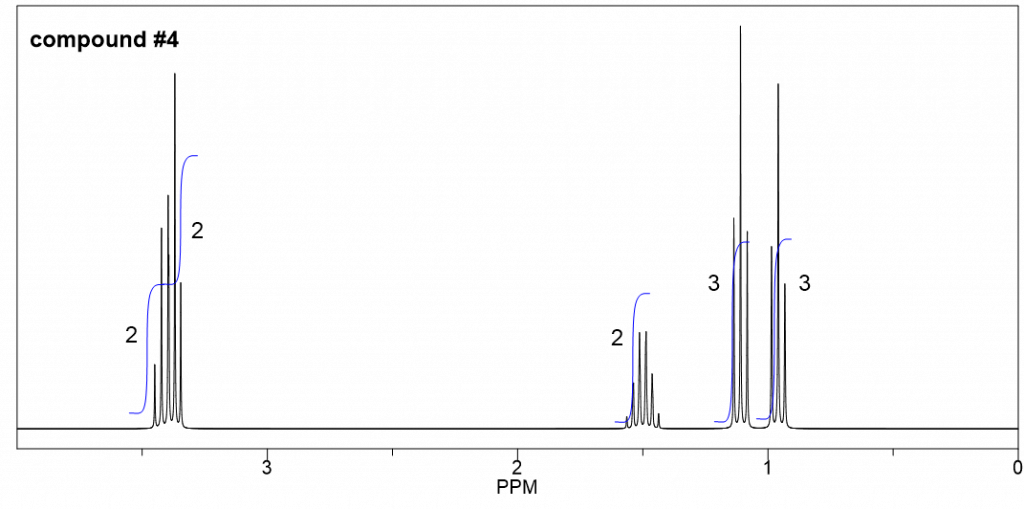
Compuesto 4
- A partir de la integración, se determina que existen:
- un grupo CH 3 muestra un triplete;
- otros grupos CH 3 muestran un triplete;
- un grupo CH 2 muestra un multiplete;
- dos grupos CH 2 con señales superpuestas
- Los dos grupos CH 3 ambos como triplete indican que ambos se conectan con CH 2, por lo que hay dos grupos etilo CH 2 CH 3 en la estructura, y no son equivalentes.
- Por lo tanto sólo queda un grupo CH 2 más.
- Solo hay una estructura posible con dos grupos CH 2 CH 3, un grupo CH 2 y un átomo de oxígeno, por lo que la estructura del compuesto 4 es etil metil éter.