7.1: Resumen de la reacción de sustitución nucleofílica
- Page ID
- 76455
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Comencemos con un ejemplo simple de reacción de sustitución:
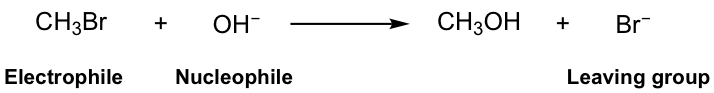
En esta reacción, el Br en el reactivo metilbromuro (CH 3 Br) se reemplaza por el grupo OH, y se produce el metanol (CH 3 OH) como producto principal, junto con bromuro Br-, el producto secundario. Es fácil entender que se trata de una reacción de sustitución, porque Br es sustituido por OH.
Las discusiones adicionales sobre esta simple reacción requieren la introducción de algunos términos clave que son críticos para entender por qué y cómo procede la reacción de esta manera. Estos términos son electrófilo, nucleófilo y grupo saliente.
Electrofilo
El reactivo CH 3 Br es un haluro de alquilo. El enlace C-X (X: F, Cl y Br) en haluro de alquilo es polar porque el halógeno es más electronegativo que el carbono, y como resultado el carbono tiene una carga positiva parcial y el halógeno tiene una carga negativa parcial.
![]()
Debido a la carga positiva parcial sobre el carbono, el átomo de carbono en el enlace C-X es deficiente en electrones, y va a buscar reactivo rico en electrones con el que conectarse. Tal especie deficiente en electrones se llama electrófilo (phile es el sufijo griego significa “amor”), significa la especie que ama los electrones. Las especies deficientes en electrones suelen ser electrófilos. Otros ejemplos de electrófilos incluyen iones con carga positiva y átomo con octeto incompleto, por ejemplo: H +, CH 3 +, BH 3, BeF 2, AlCl 3.
Para CH 3 Br en esta reacción, es el átomo de carbono el que actúa como electrófilo, y el carbono puede denominarse como carbono electrófilo.
El compuesto CH 3 Br que se somete a la sustitución generalmente se puede llamar el sustrato. NucleófiloEl hidróxido, OH —, es otro reactivo en la reacción anterior. Se muestra claramente con la estructura Lewis del OH —que el átomo de oxígeno tiene tres electrones de pares solitarios y está cargado negativamente, por lo que es una especie rica en electrones con alta densidad de electrones.
![]()
Una especie rica en electrones se llama nucleófila (el “núcleo” proviene del núcleo, eso significa carga positiva), es decir, el reactivo que busca especies cargadas positivamente o pobres en electrones con las que reaccionar. OH — es el nucleófilo para la reacción anterior. Generalmente, cualquier especie con el par de electrones disponible para compartir podría ser nucleófila. Los nucleófilos pueden estar cargados negativamente (Nu: —), o neutros (Nu:), por ejemplo: OR —, H 2 O, ROH, NH 3, RNH 2, RCOO — son todos nucleófilos posibles.
Basado en la comprensión de los conceptos de electrófilo y nucleófilo, ¡probablemente te das cuenta de que un nucleófilo podría reaccionar con un electrófilo! Sí, esa es la regla muy importante y fundamental para la reacción orgánica: cuando los nucleófilos ricos en electrones se encuentran con electrófilo deficiente en electrones, se produciría una reacción orgánica.
Grupo de salida
Para asegurar que se produzca la sustitución anterior, otro factor crítico es que el Br debe salir junto con los pares de electrones en el enlace C-Br, y el bromuro, Br-, se denomina grupo saliente. El grupo saliente (LG) sale con el par de electrones de unión, y es reemplazado por el nucleófilo en la reacción de sustitución. Sin un grupo saliente adecuado, incluso el nucleófilo se siente atraído por el electrófilo, la reacción de sustitución aún no puede avanzar. Dejar el grupo puede ser cargado negativamente o ser neutral, como veremos en discusiones detalladas más adelante.
Aplicando los tres términos clave, la reacción de sustitución anterior se puede resumir como: el nucleófilo desplaza al grupo de salida en un sustrato, por lo que dicha reacción se denomina reacción de sustitución nucleofílica. Por lo tanto, la reacción de sustitución nucleofílica podría mostrarse de una manera más general:
![]()
Nota: el grupo nucleófilo y saliente no son necesarios cargados negativamente, podrían ser neutros como se mencionó anteriormente.
Cinética de la reacción de sustitución nucleofílica
La cinética es el estudio que se refiere a la velocidad de una reacción química, o qué tan rápido ocurre la reacción. Los datos de velocidad de reacción ayudan a arrojar luz sobre la comprensión del mecanismo de reacción, el proceso paso a paso de transferencia de electrones. Los estudios cinéticos sobre las reacciones de sustitución nucleofílica indican que existen dos expresiones de ley de velocidad diferentes para tales reacciones. Para las dos reacciones siguientes, la reacción 1 está en segundo orden mientras que la reacción 2 está en primer orden. La única razón detrás de la diferente velocidad cinética es que las reacciones pasan por diferentes mecanismos de reacción.
![CH3Br + OH- = CH3OH + Br-, Velocidad de Reacción = k veces [CH3Br] veces OH-](https://chem.libretexts.org/@api/deki/files/397583/Kinetics-rx1.png)
La reacción 1 es la reacción de sustitución con la que ya estamos familiarizados. Es una reacción de segundo orden. Eso significa que la velocidad de reacción depende de la concentración tanto del sustrato CH 3 Br como del nucleófilo OH —. Si la concentración de CH 3 Br se duplicó, la velocidad de reacción se duplicó, y si la concentración de OH — se duplicó, la velocidad de reacción también se duplicó. Cuando la concentración tanto de CH 3 Br como de OH — se duplicó, la velocidad de reacción aumentó en un factor de cuatro.
![(CH3) 3cBr + H20 = (CH3) 3COH + HBr, velocidad de reacción = k veces [(CH3) 3Br]](https://chem.libretexts.org/@api/deki/files/397584/Kinetics-rx2.png)
La reacción 2 es otro ejemplo de reacción de sustitución. El sustrato aquí es un bromuro terciario y el nucleófilo es una molécula de agua neutra. Como reacción de primer orden, la velocidad de reacción depende únicamente de la concentración de sustrato (CH 3) 3 cBr y no tiene nada que ver con nucleófilo.
Los dos tipos de reacciones corresponden a dos tipos de mecanismo de reacción:
- La reacción de segundo orden pasa por el mecanismo de reacción bimolecular que se llama reacción S N 2, es decir, S ubstitution, N ucleophilic y Bi molecular.
- La reacción de primer orden pasa por el mecanismo de reacción unimolecular que se llama reacción S N 1, significando S ubstitution, N ucleophilic y Uni molecular.
Tendremos discusiones detalladas sobre el mecanismo S N 2 y S N 1 respectivamente, para luego comparar las similitudes y diferencias entre ellos.


