7.2: Mecanismo de Reacción SN2, Diagrama de Energía y Estereoquímica
- Page ID
- 76463
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Mecanismo de reacción S N 2
Todavía tomemos la reacción entre CH 3 Br y OH —como ejemplo para el mecanismo S N 2.
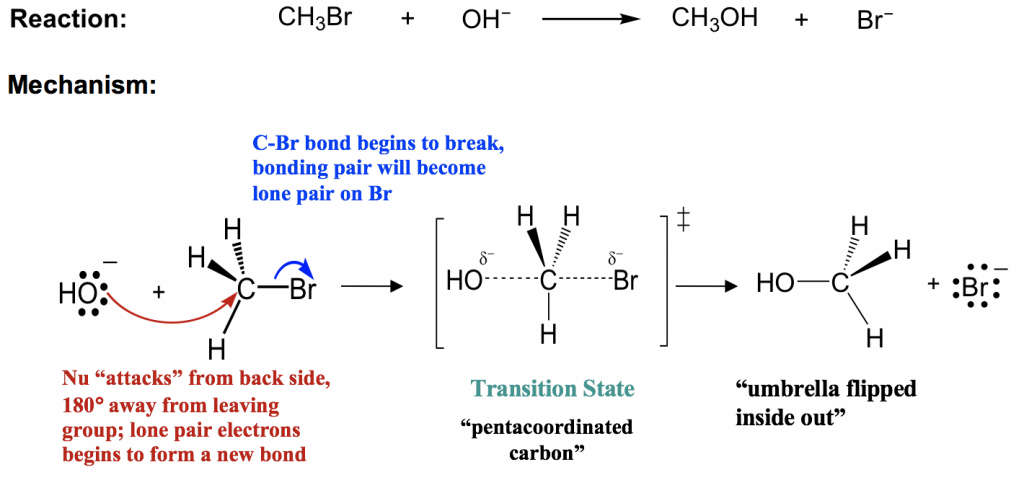
El mecanismo S N 2 implica dos transferencias de pares de electrones que ocurren al mismo tiempo, ataque nucleofílico (flecha roja) y salida del grupo de salida (flecha azul). El nucleófilo OH — se acerca al carbono electrófilo desde la parte posterior, el lado que es opuesto a la dirección que sale del grupo Br que sale. Con el nucleófilo OH —acercándose, el Br empieza a irse también. La formación de nuevos enlaces C—OH y la rotura del enlace C—Br se producen al mismo tiempo. En un momento transitorio muy corto, el átomo de carbono está parcialmente conectado tanto con OH como con Br, lo que da un estado de nivel de energía más alto de todo el proceso llamado estado de transición. En el estado de transición de la reacción de S N 2, hay cinco grupos alrededor del carbono y el carbono puede llamarse “pentacoordinado”. A medida que el OH — continúa acercándose al carbono, el Br se aleja más de él con el par de electrones de enlace. Finalmente, el nuevo enlace se forma completamente y el enlace viejo se rompe completamente lo que le da al producto CH 3 OH.
En el mecanismo, la reacción procede en un solo paso que involucra tanto al nucleófilo como al sustrato, por lo que aumentar la concentración de cualquiera de ellos hace que aumente la posibilidad de colisión, eso explica la cinética de segundo orden de la reacción de S N 2. Con tanto el ataque nucleofílico como el abandono del grupo que sale suceden al mismo tiempo, también se dice que S N 2 es un mecanismo concertado, concertado significa simultáneo.
Notas para el dibujo S N 2 mecanismo:
- Las dos flechas deben mostrarse al dibujar el mecanismo S N 2. Ambos tienen que mostrarse con la dirección adecuada: ataque nucleofílico desde la dirección que es opuesta al grupo de salida deja, es decir, ataque posterior.
- El estado de transición es optativo (depende del requerimiento de la pregunta). Sin embargo, es importante entender que el proceso de reacción pasa por el estado de transición antes de producir los productos.
- Por favor, preste atención a que para el producto, las posiciones de los tres hidrógenos alrededor del carbono se empujan hacia el otro lado, y la configuración general del carbono se invierte, como un paraguas volteado del revés en una tormenta de viento. Parece que realmente no importa para el producto (CH 3 OH) en esta reacción, sin embargo sí hace la diferencia si el carbono es un centro de quiralidad.
Diagrama de Energía del Mecanismo S N 2
Los cambios de energía para la reacción anterior se pueden representar en el diagrama de energía mostrado en la Fig. 7.1. S N 2 es una reacción de un solo paso, por lo que el diagrama tiene una sola curva. Los productos CH 3 OH y Br —están en menor energía que los reactivos CH 3 Br y OH —, indica que la reacción global es exotérmica y los productos son más estables.
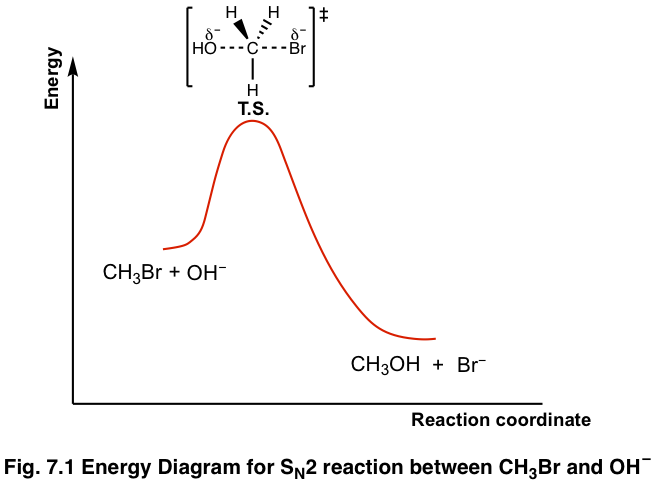
La parte superior de la curva corresponde al estado de transición, que es la estructura de mayor energía involucrada en la reacción. El estado de transición siempre involucra enlaces parciales, enlaces parcialmente formados y enlaces parcialmente rotos, y por lo tanto es muy inestable sin una vida útil apreciable. El estado de transición, por lo tanto, nunca se puede aislar. La estructura de los estados de transición generalmente se muestra en corchetes con un superíndice de doble daga.
El efecto de la estructura de haluro de alquilo sobre la velocidad de reacción de S N 2
Para las discusiones sobre el mecanismo S N 2 hasta el momento, nos enfocamos en la reacción del metilbromuro CH 3 Br. Otros haluros de alquilo también podrían sufrir reacciones de S N 2. Los estudios sobre la velocidad de reacción para S N 2 indican que la categoría de estructura del carbono electrófilo en haluro de alquilo afecta drásticamente la velocidad de reacción.
| Tipo de haluro de alquilo |
Haluro alquílico
Estructura
Tasa Relativa
MethylCH 3 X
30 Primaria (1 °) RCH 2 — X 1 Secundaria (2 °)
(sin reacción SN2)
Tabla 7.1 Velocidad de reacción relativa de SN2 para diferentes tipos de haluro de alquilo
Como se muestra en la Tabla 7.1, el metilo y los halogenuros primarios son los sustratos con mayor tasa, la tasa disminuye mucho para los halogenuros secundarios, y los halogenuros terciarios no experimentan reacción de S N 2 en absoluto debido a que la velocidad es demasiado baja para ser práctica.
Por lo tanto, la reactividad relativa de los haluros de alquilo hacia la reacción de S N 2 se puede resumir como:

¿Por qué la tendencia es así? Esto puede explicarse por el mecanismo de reacción de S N 2. En realidad esta es una de las evidencias experimentales en las que se basan los científicos para proponer el mecanismo. Una característica clave en el mecanismo S N 2 es que el nucleófilo ataca desde la parte posterior. Cuando los nucleófilos se acercan al carbono, es más fácil acercarse al carbono metílico porque los átomos de hidrógeno conectados en el carbono son de tamaño pequeño. Con el tamaño de los grupos conectados en el carbono cada vez más grande, cada vez es más difícil acceder al carbono, y tal aproximación está totalmente bloqueada para el carbono terciario con tres grupos alquilo voluminosos conectados. Por lo tanto, la diferencia de reactividad es causada esencialmente por el efecto estérico. El efecto estérico es el efecto que se basa en el tamaño o volumen estérico de un grupo. Debido al impedimento estérico de los grupos voluminosos en el carbono electrófilo, es menos accesible para los nucleófilos realizar un ataque posterior, por lo que la velocidad de reacción de S N 2 de los sustratos secundario (2°) y terciario (3°) disminuye drásticamente. En realidad los sustratos de 3° nunca van con el mecanismo de reacción de S N 2 porque la velocidad de reacción es demasiado lenta.
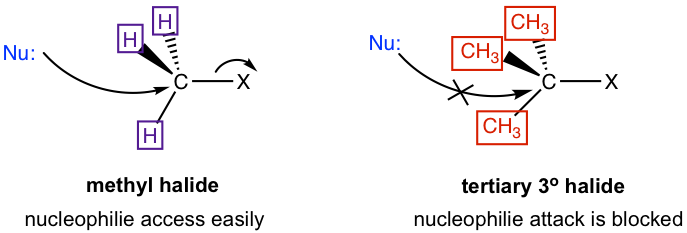
La estereoquímica de la reacción de S N 2
Otra característica del mecanismo de reacción de S N 2 es que la configuración general del carbono en el producto se invierte en comparación con la del reactivo, como un paraguas volteado de adentro hacia afuera. Dicha inversión de configuración se llama inversión Walden. Veamos cuál es la consecuencia estereoquímica de tal inversión.
Comenzando con el (R) -2-bromobutano, la reacción de S N 2 produce solo un enantiómero del producto 2-butanol, y es predecible que la configuración del producto se supone que es S debido a la inversión de configuración.
Nota: Inversión significa que la disposición de los grupos consigue invertida, no necesaria significa la configuración absoluta, R/S, invertida. El producto obtiene una configuración R/S invertida comparando con el reactivo para casos de lote, pero no garantizada. La configuración real del producto tiene que ser determinada en consecuencia.Ejercicios 7.1
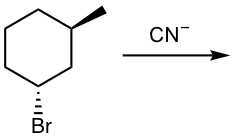
Mostrar el producto de la siguiente reacción de S N 2 (CN — es el nucleófilo):