7.6: Temas adicionales sobre la reacción de sustitución nucleofílica
- Page ID
- 76478
Nuestras discusiones hasta ahora se centran en los conceptos fundamentales sobre el mecanismo S N 1 y S N 2, y las reacciones que aprendimos proceden de manera regular. Hay algunas otras condiciones que se pueden “agregar” a las reacciones básicas de sustitución nucleofílica, para hacer que la reacción se vea diferente, o más desafío. Sin embargo, entender bien los conceptos básicos es muy útil para que podamos enfrentar diversas situaciones. La reacción puede verse diferente, pero esencialmente sigue siendo la misma.
7.6.1 Reacción de S N 1 con reordenamiento de carbocationes
Echemos un vistazo a una reacción de S N 1.
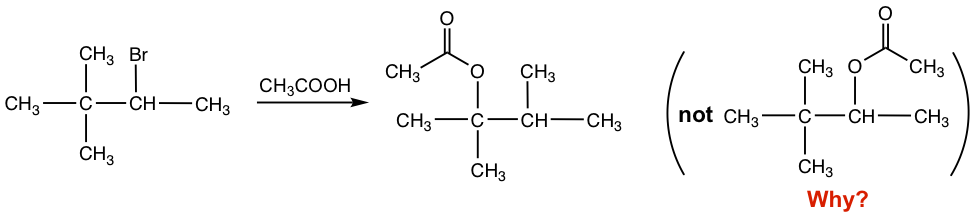
Con el sustrato secundario y nucleófilo neutro (CH 3 COOH), esta es una reacción de S N 1, y solvolisis que CH 3 COOH actúa como solvente y nucleófilo. Se supone que debe dar el acetato como producto, con el acetato reemplazar el Br. Sin embargo, como se muestra en la ecuación de reacción, el acetato no se introdujo en el carbono con el grupo lábil Br, sino que se conectó en el siguiente carbono en su lugar. ¿Cuál es el motivo de la inesperada estructura del producto?
Para las reacciones que involucran carbocationes intermedios, es un fenómeno común que el carbocatión podría reorganizarse, si tal reordenamiento conduce a un carbocatión más estable, y esto se denomina reordenamiento de carbocationes. Debido al reordenamiento de los carbocationes, el producto de la reacción anterior es diferente de lo esperado. Esto se puede explicar con el mecanismo paso a paso a continuación.

Cuando Br — sale, el carbocatión inicial formado es secundario. El grupo CH 3 en el siguiente carbono luego se desplaza con sus electrones de unión al carbono cargado positivamente, y creando un nuevo carbocatión terciario más estable. El carbocatión terciario reacciona entonces con el nucleófilo CH 3 COOH para dar el producto de acetato final. El grupo CH 3 desplaza con el par de electrones, y tal movimiento se denomina 1,2-metanidesdesplazamiento. “1,2- “aquí se refieren al movimiento que ocurren entre dos carbonos adyacentes, no necesariamente significa C1 y C2.
Aparte del grupo CH 3, el átomo de H en otras reacciones podría cambiar también con el par de electrones, si tal desplazamiento puede conducir a un carbocatión más estable. El desplazamiento del hidrógeno se llama desplazamiento 1,2-hidruro. Un par de notas sobre el reordenamiento de los carbocationes:
- Cualquier reacción que implique carbocatión intermedio podría tener reordenamiento.
- No todos los carbocationes se reordenan. Los carbocationes solo se reordenan si se vuelven más estables como resultado del reordenamiento.
- El desplazamiento suele ser 1,2-desplazamiento, lo que significa que ocurre entre dos carbonos adyacentes.
7.6.2 Reacción de Sustitución Nucleofílica Intramolecular
Para las reacciones que aprendimos antes, el sustrato con grupo lábil y el nucleófilo son siempre dos compuestos separados. En realidad es posible que un compuesto contenga tanto el grupo lábil como el nucleófilo, y la reacción ocurre dentro de la misma molécula. Tal reacción se llama la reacción intramolecular (intra, latín para “dentro”). El producto cíclico se obtiene de la reacción intramolecular.
Hablemos del mecanismo de reacción que racionaliza la estructura y estereoquímica del producto para la siguiente reacción.
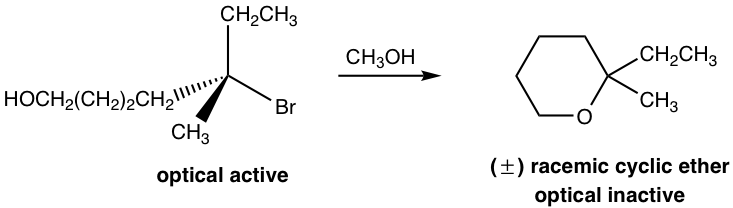

En la reacción anterior, el reactivo tiene dos grupos funcionales, bromuro (Br) y alcohol (OH). Un compuesto con dos grupos funcionales se denomina molécula bifuncional. En este reactivo, Br está conectado sobre un carbono terciario que es un buen sustrato para la reacción SN1, y el OH es un buen nucleófilo para S N 1 también, por lo que la reacción de sustitución podría ocurrir dentro de la misma molécula a través del mecanismo de S N 1. Entonces la reacción ocurre entre un extremo de la molécula, Br, que actúa como grupo de salida, y la otra parte de la molécula, OH, que actúa como el nucleófilo. Como resultado, se forma un éter cíclico de seis miembros como producto.
Dado que la reacción ocurre con el mecanismo SN1, el carbocatión intermedio está en forma plana trigonal, y el nucleófilo puede atacar desde cualquier lado del carbocatión para dar ambos enantiómeros. Por lo tanto, el producto es la mezcla racémica que es óptica inactiva. Esto es consistente con la característica estereoquímica de la reacción de S N 1 que aprendimos antes.
Por lo general, si la reacción intramolecular pudiera producir un anillo de cinco o seis eslabones como producto, la reacción se verá muy favorecida debido a la especial estabilidad del anillo de cinco o seis eslabones.
7.6.3 Convertir un grupo pobre que sale en un grupo de salida bueno
En las primeras discusiones sobre los grupos de salida (sección 7.3), hemos mencionado la importancia de un buen grupo de salida tanto para las reacciones de S N 1 como de S N 2, que la reacción de sustitución no ocurrirá es un grupo de salida pobre presente. Sin embargo, para algunas situaciones, el grupo de salida pobre podría convertirse en un buen grupo de salida para hacer factible la reacción. Veremos un par de estrategias para tal fin.
Por Catalizador Acido H +
Ejemplo: Proponer el mecanismo para racionalizar la reacción.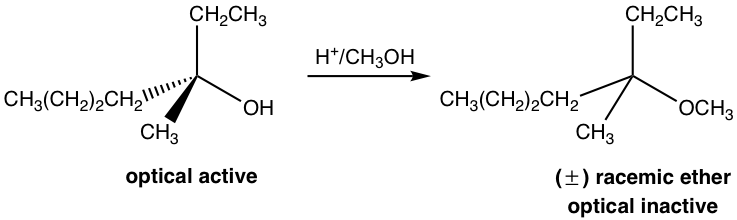
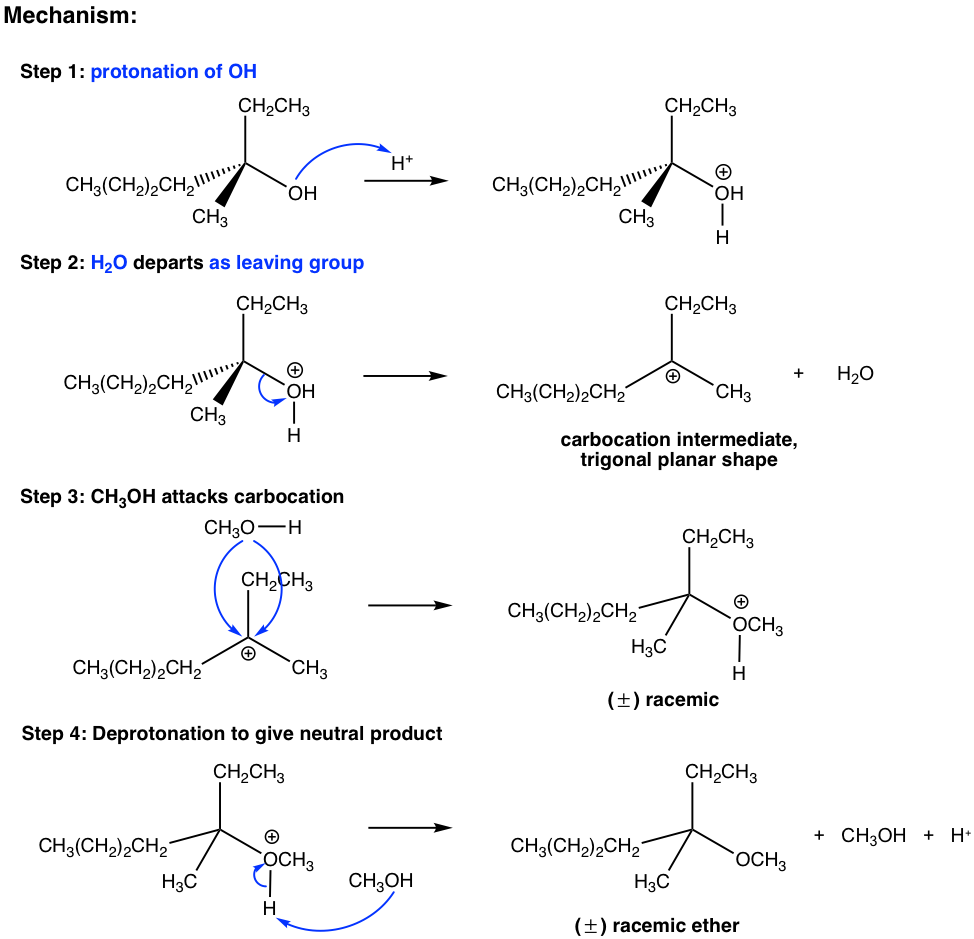
Los tres últimos pasos en el mecanismo anterior son los pasos estándar del mecanismo S N 1. No obstante, la reacción no procederá sin el primer paso. En el primer paso, que es una reacción ácido-base, un protón se transfiere rápidamente al grupo OH, y se obtiene el alcohol protonado. Por protonación, el grupo OH se convierte en H 2 O, es decir, una base mucho más débil, por lo tanto, un buen grupo de salida. En el paso 2, la molécula de agua sale con el par de electrones y deja atrás un carbocatión intermedio. Los siguientes pasos son solo S N 1, eso explica por qué el producto es la mezcla racémica. El ácido H + se regeneró en la etapa 4 y se puede reutilizar para posteriores reacciones, por lo que solo es necesaria la cantidad catalítica de H + para iniciar el proceso.
Por cloruro de sulfoniloOtro método comúnmente aplicado para convertir el grupo OH en un mejor grupo lábil es mediante la introducción de un éster de sulfonato. Cuando el alcohol reacciona con cloruro de sulfonilo, con presencia de base débil, se forma el éster de sulfonato.
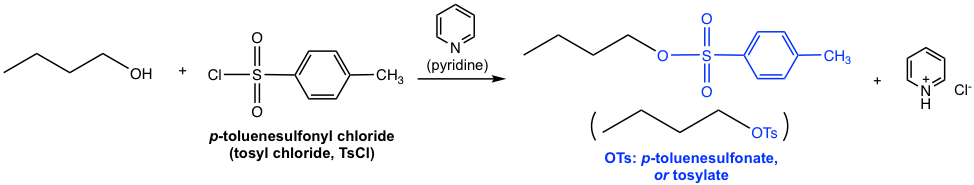
Como el ejemplo mostrado anteriormente, cuando se usa cloruro de p-toluenosulfonilo (cloruro de tosil, TsCl), el éster resultante es p-toluenosulfonato (tosilato, OTs). ¿El grupo tosyl te resulta familiar? Sí, lo aprendimos con esta especie en la sección 3.2. Como base conjugada del ácido p-toluensulfónico ácido fuerte (TsOH), los OTs son la base muy débil y por lo tanto un excelente grupo lábil. La piridina aquí actúa como la base débil para neutralizar el producto secundario HCl y facilitar la reacción hasta su finalización. En este curso no se requiere el mecanismo detallado para esta reacción.
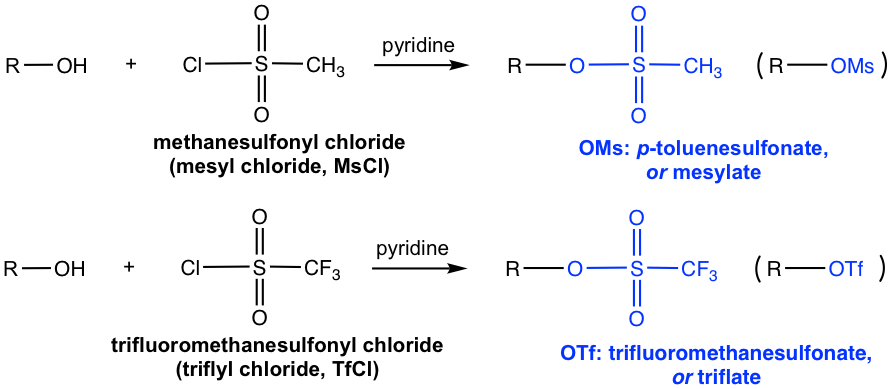
Aparte de introducir OTs, otros cloruros de sulfonilo comúnmente aplicados incluyen MsCl y TfCl, y el éster de sulfonato OMs (mesilato) y OTf (triflato) se forman respectivamente.
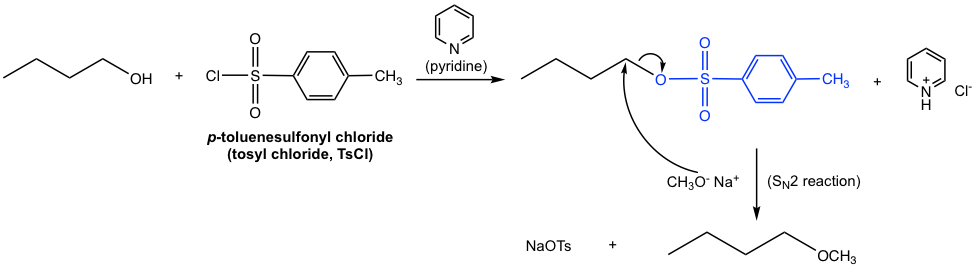
Una vez que el alcohol primario se ha convertido en OTs (o OMs, OTf), es entonces el buen sustrato para la reacción de S N 2. Con el nucleófilo apropiado agregado en una etapa separada, por ejemplo CH 3 O —, la reacción de S N 2 tiene lugar fácilmente para dar éter como producto final, como se muestra a continuación.
La síntesis global de butil metil éter a partir de 1-butanol implica dos etapas separadas: la conversión de OH a OTs, y luego la sustitución de OTs por CH 3 O a través de reacción de S N 2. Los dos pasos tienen que llevarse a cabo uno tras otro, sin embargo, todo el esquema de síntesis también se puede mostrar de la siguiente manera:
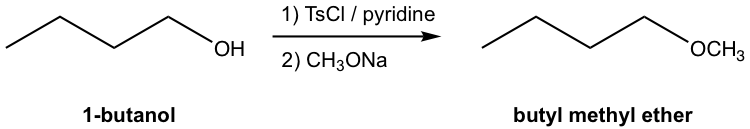
Nota:
- La Figura 7.6j representa la manera común y convencional de mostrar la síntesis de múltiples etapas en química orgánica. Las condiciones de reacción (reactivo, catalizador, disolvente, temperatura etc.) para cada etapa se muestran en la parte superior e inferior de la flecha de ecuación. Solo se muestran las estructuras del material de partida y producto (s) final (s), y no se incluyen las estructuras de los productos intermedios para cada etapa.
- Los pasos individuales necesitan ser etiquetados como 1), 2) etc. para el orden adecuado, no se pueden mezclar entre sí.


