7.5: SN1 vs SN2
- Page ID
- 76441
7.5.1 Comparación entre las reacciones de S N 1 y S N 2
Hasta ahora, hemos terminado los conceptos básicos sobre las reacciones de S N 1 y S N 2. Probablemente ya te diste cuenta de que los dos tipos de reacciones tienen algunas similitudes, aunque también bastante diferentes. Será muy útil ponerlos juntos para compararlos. Para ayudarlo a comprender en profundidad los dos tipos de mecanismos, es muy recomendable que tenga un resumen a su manera. La siguiente comparación se proporciona aquí para su referencia.
|
S N 1 |
S N 2 |
|
| Ley de tarifas |
Tasa = k [electrófilo] |
Tasa = k [nucleófilo] × [electrófilo] |
| Mecanismo |
múltiples etapas con carbocatión intermedio |
un paso, concertado |
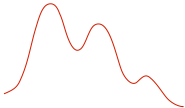
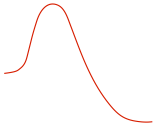
| Diagrama de reacción |
|
|
| Estereoquímica |
racemización en el centro de reacción |
inversión en el centro de reacción |
| Sustrato electrofílico | terciario 3 ° > secundario 2 ° > primario 1 ° y metilo |
primario 1 ° y metilo > secundario 2 ° > terciario 3 ° |
| Nucleófilo |
nucleófilo débil, solvolisis |
nucleófilo fuerte |
7.5.2 Efecto del Solvente sobre las Reacciones Sn1 y S N 2
Aparte de los factores de los que hemos hablado hasta ahora, el solvente es otro factor clave que afecta las reacciones de sustitución nucleofílica. Se requiere un solvente adecuado para facilitar cierto mecanismo. En algunos casos, recoger el disolvente apropiado es la manera efectiva de controlar en qué vía procede la reacción.
Para entender el efecto solvente, primero que nada necesitamos tener discusiones más detalladas sobre solventes, luego aprender a elegir un buen solvente para una reacción específica.
Los solventes se pueden dividir en tres categorías principales en función de las estructuras y polaridades, es decir: solventes no polares, próticos polares y apróticos polares.
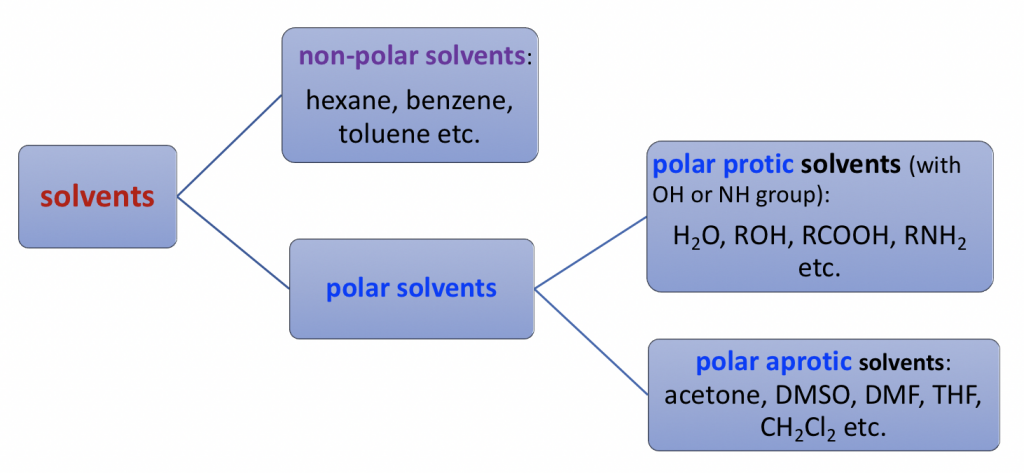
Los disolventes no polares son compuestos no polares. (hexano, benceno, tolueno, etc.)
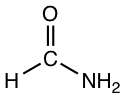
Los disolventes próticos polares son los compuestos que contienen el grupo OH o NH que es capaz de formar enlaces de hidrógeno. Los solventes próticos polares son altamente polares debido al grupo OH o NH.
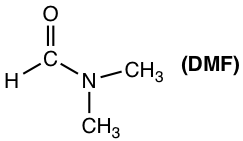
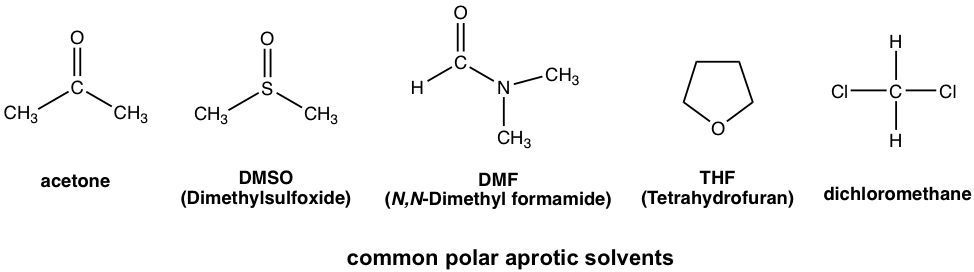
Los disolventes apróticos polares son un grupo de disolventes con rango medio de polaridad. Son polares debido a enlaces polares como C=O o S=O, pero la polaridad no es tan alta como el grupo OH o NH. Los ejemplos típicos de disolventes apróticos polares incluyen acetona, DMSO, DMF, THF, CH 2 Cl 2.
La guía general para disolventes respecto a la reacción de sustitución nucleofílica es:
- Las reacciones de S N 1 son favorecidas por disolventes próticos polares (H 2 O, ROH etc.), y generalmente son reacciones de solvolisis.
- Las reacciones de S N 2 son favorecidas por disolventes apróticos polares (acetona, DMSO, DMF, etc.).
Los solventes próticos polares favorecen las reacciones de S N 1
En la reacción de S N 1, el grupo lábil sale y el carbocatión se formó en la primera etapa, que también es la etapa determinante de la velocidad. El disolvente polar, como el agua, MeOH, es capaz de formar enlaces de hidrógeno con el grupo lábil en el estado de transición de la primera etapa, disminuyendo así la energía del estado de transición que conduce al carbocatión, y acelera la etapa determinante de la velocidad. Como resultado, los solventes próticos polares facilitan las reacciones de S N 1. Es muy común que los solventes próticos polares sirvan como nucleófilos también para las reacciones de S N 1, por lo que generalmente las reacciones de S N 1 son reacciones de solvolisis como aprendimos anteriormente.

Los solventes apróticos polares favorecen las reacciones de S N 2
Se requieren nucleófilos fuertes en las reacciones de S N 2, y los nucleófilos fuertes suelen ser especies con carga negativa, como OH —, CH 3 O —, CN — etc. Estos aniones deben permanecer con cationes en formato de sal como NaOH, CH 3 ONa etc. ya que las sales son insolubles en disolventes no polares, por lo tanto, los disolventes no polares no son opciones apropiadas, y necesitamos disolventes polares que puedan disolver las sales.
El tema para el solvente prótico polar es que los aniones nucleófilos estarán rodeados por una capa de moléculas solventes con enlaces de hidrógeno, y esto se llama el efecto de solvatación. El efecto de solvatación estabiliza (o estorba) a los nucleófilos y dificulta sus reactividades en la reacción de S N 2. Por lo tanto, los solventes próticos polares no son adecuados para reacciones de S N 2.

Como resultado, los disolventes apróticos polares, como acetona, DMSO, etc. son la mejor opción de reacciones de S N 2. Son lo suficientemente polares como para disolver los nucleófilos en formato de sal, y tampoco interactúan tan fuertemente con los aniones como para obstaculizar sus reactividades. Los aniones nucleófilos todavía se mueven libremente en disolvente aprótico polar para actuar como nucleófilo.
La velocidad de reacción para una reacción de S N 2 en diferentes disolventes se proporciona en la siguiente tabla, y el disolvente aprótico polar DMF demostró ser la mejor opción que acelera la reacción significativamente.
|
reacción: CH 3 I + Cl — → CH 3 Cl + I — |
|
|
solvente |
tasa relativa |
|
CH 3 OH |
1 |
|
|
12.5 |
|
|
1,200,000 |
Con todo el conocimiento sobre las reacciones de S N 1, S N 2 y las condiciones de reacción, debemos ser capaces de determinar si una reacción dada va con la vía S N 1 o S N 2, o diseñar una reacción adecuada que produzca el producto o productos deseados. La vía de reacción depende predominantemente de la naturaleza de los sustratos (primarios, secundarios o terciarios), y la elección de las condiciones de reacción adecuadas sirven como una forma de facilitar el proceso.
- Los sustratos primarios y metílicos experimentan predominantemente reacción de S N 2.
- Los sustratos terciarios van con el proceso S N 1.
- La reacción de sustratos secundarios se basa principalmente en las condiciones aplicadas. La condición incluye nucleófilo, solvente, etc. Vea ejemplos para discusiones más detalladas.
Ejercicios 7.4
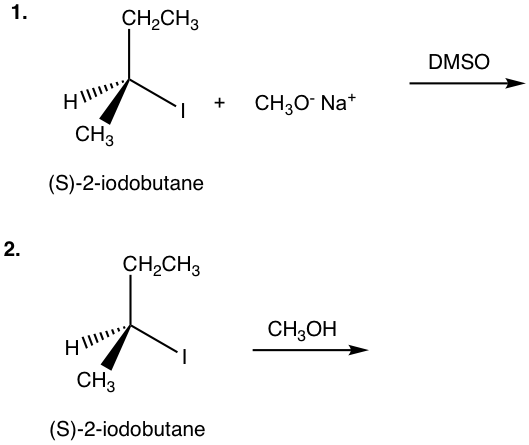
Mostrar el (los) producto (s) de las siguientes reacciones:
- (S) -2-yodobutano + CH 3 O — Na + (DMSO →_
- (S) -2-yodobutano (CH 3 OH →_
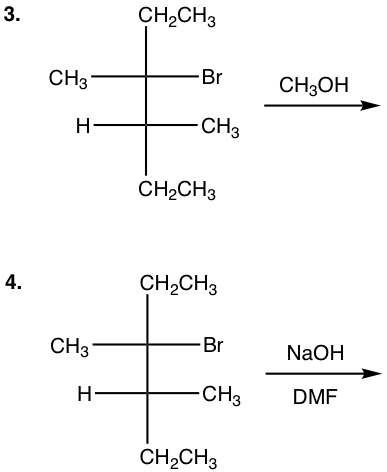
Respuestas a las preguntas de práctica Capítulo 7
Algunos consejos prácticos para trabajar en las reacciones de S N 1, S N 2:
- Como entendemos que se requieren nucleófilos fuertes para la reacción SN2, y la mayoría de los nucleófilos fuertes son aquellos con cargas negativas, por ejemplo OH —, OR —. Estos nucleófilos pueden mostrarse ya sea como aniones OH —, CH 3 O —, C 2 H 5 O —, o en formato de sal como NaOH, KOH, CH 3 ONa, C 2 H 5 ONa en las condiciones de reacción. Debes entender que es lo mismo. Los formatos aniónicos son fáciles de identificar y también destacan la naturaleza de estas especies, sin embargo, dado que los aniones deben permanecer juntos con los contracationes como sal, el formato de sal muestra la fórmula química real del compuesto utilizado en la reacción.
- Dado que el disolvente aprótico polar favorece las reacciones de S N 2, por lo que cualquiera de los aniones o sal anteriores se puede usar junto con DMSO, DMF etc, como OH — /DMSO, CH 3 ONA/DMF etc.
No obstante, a veces se puede ver la combinación como CH 3 ONA/CH 3 OH, que es la combinación de CH 3 O —junto con su ácido conjugado CH 3 OH. Puede parecer contradictorio, ¿por qué un nucleófilo fuerte para S N 2 se combina con disolvente para S N 1? La realidad es que CH 3 ONa aquí todavía actúa como nucleófilo fuerte y puede usarse para la reacción de S N 2 y CH 3 OH es el disolvente para CH 3 ONa. La razón por la que CH 3 OH se usa juntos como disolvente es que el CH 3 ONa se puede preparar tratando un alcohol con Na. Por ejemplo:
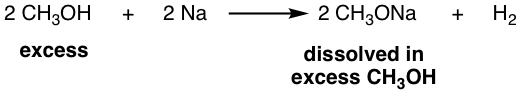
Otro alcohol también puede reaccionar con Na metal (o potasio metal, K) para generar el correspondiente RonA.
También se puede usar la reacción entre alcohol y NaH.
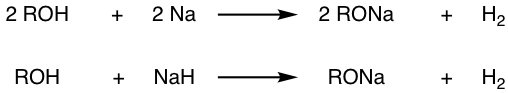 Dado que el alcohol está en exceso en las reacciones anteriores, también es un buen disolvente para el alcóxido resultante, y la combinación RO — /ROH se usa comúnmente junto. El RO — en esta combinación se puede utilizar como nucleófilo fuerte para la reacción de S N 2, o base en la reacción de eliminación (Capítulo 8).
Dado que el alcohol está en exceso en las reacciones anteriores, también es un buen disolvente para el alcóxido resultante, y la combinación RO — /ROH se usa comúnmente junto. El RO — en esta combinación se puede utilizar como nucleófilo fuerte para la reacción de S N 2, o base en la reacción de eliminación (Capítulo 8).