8.1: Reacción E2
- Page ID
- 76527
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\dsum}{\displaystyle\sum\limits} \)
\( \newcommand{\dint}{\displaystyle\int\limits} \)
\( \newcommand{\dlim}{\displaystyle\lim\limits} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\(\newcommand{\longvect}{\overrightarrow}\)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)8.1.1 Mecanismo E2
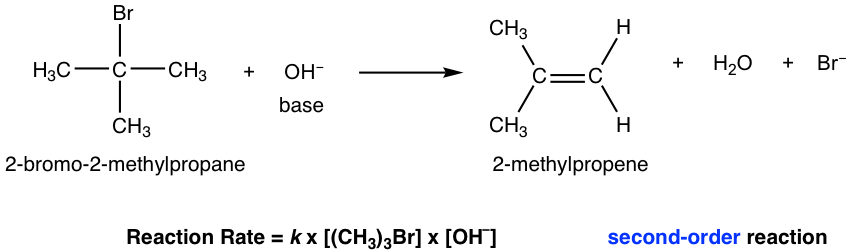
El mecanismo E2 es el mecanismo de eliminación bimolecular, que la velocidad de reacción depende de la concentración tanto del sustrato como de la base. Tomaremos como ejemplo de discusión la reacción de eliminación del 2-bromo-2-metilpropano.
El mecanismo E2 también es una reacción concertada de un solo paso, similar a S N 2, con múltiples transferencias de pares de electrones ocurren al mismo tiempo.
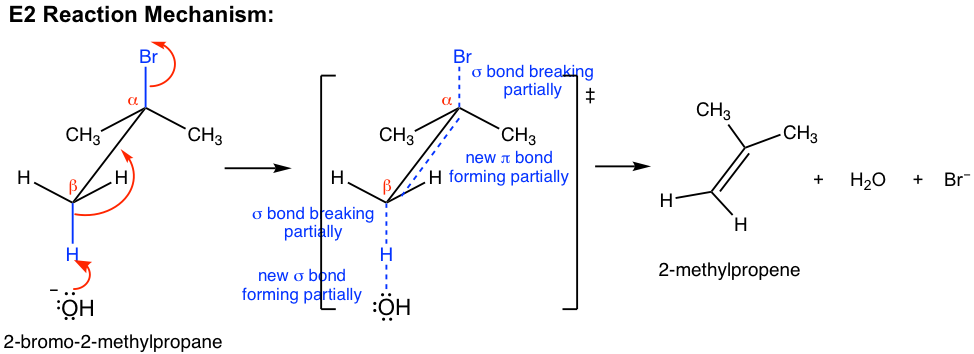
Base, OH —, utiliza su par de electrones para atacar un β-hidrógeno en β-carbono, y comienza a formar un enlace; al mismo tiempo, el enlace β C-H sigma comienza a moverse hacia adentro para convertirse en el enlace π de un doble enlace, y mientras tanto Br comienza a partir tomando los electrones de enlace con él. Se forma un estado de transición en el proceso de reacción con enlaces parcialmente rompiendo y formando parcialmente. Al finalizar la reacción, el doble enlace C=C y la molécula H 2 O están completamente formados, con Br — hojas completamente.
Dado que tanto el sustrato (haluro) como la base están involucrados en el mecanismo de una sola etapa, E2 es la reacción de segundo orden.
8.1.2 Regioselectividad de la reacción E2: Regla de Zaitsev vs Regla Hofmann
Para la reacción que hablamos en la sección anterior, hay tres β-carbonos en el sustrato 2-bromo-2-metilpropano, sin embargo todos son idénticos, por lo que la reacción da solo un solo producto de eliminación 2-metilpropeno.
Para otros haluros de alquilo, si hay diferentes β-carbonos en el sustrato, entonces la reacción de eliminación puede producir más de un producto. Por ejemplo, la deshidrohalogenación de 2-bromo-2-metilbutano puede producir dos productos, 2-metil-2-buteno y 2-metil-1-buteno, siguiendo dos vías diferentes.
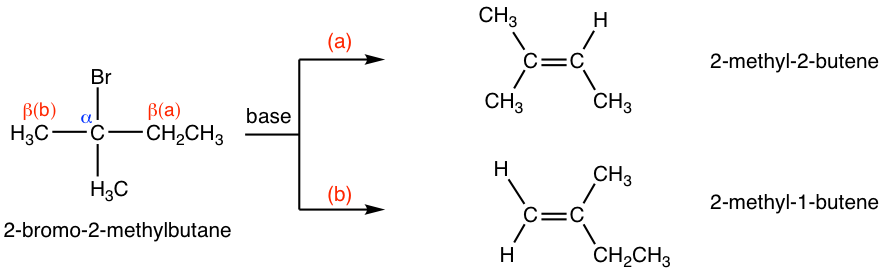
Entre los dos posibles productos, el 2-metil-2-buteno es un alqueno trisustituido, mientras que el 2-metil-1-buteno es monosustituido. Para los alquenos, cuantos más grupos alquilo unidos en los carbonos del doble enlace, más estable es el alqueno. Generalmente, la estabilidad relativa de alquenos con diferente cantidad de sustituyentes es:
tetrasubstituidos > trisustituidos > disustituidos > monosustituidos > eteno
Por lo tanto, el 2-metil-2-buteno es más estable que el 2-metil-1-buteno. Cuando se usa una base de tamaño pequeño para la reacción de eliminación, como OH —, CH 3 O —, EtO —, resultó que la estabilidad relativa del producto es el factor clave para determinar el producto principal. Como resultado, el 2-metil-2-buteno es el producto principal para la reacción anterior.
Como tendencia general, cuando se aplica base pequeña, los productos de eliminación pueden ser predichos por regla de Zaitsev, que dicho el alqueno más sustituido se obtiene preferiblemente. Entonces, la regla de Zaitsev esencialmente puede explicarse por la mayor estabilidad de los alquenos más sustituidos.
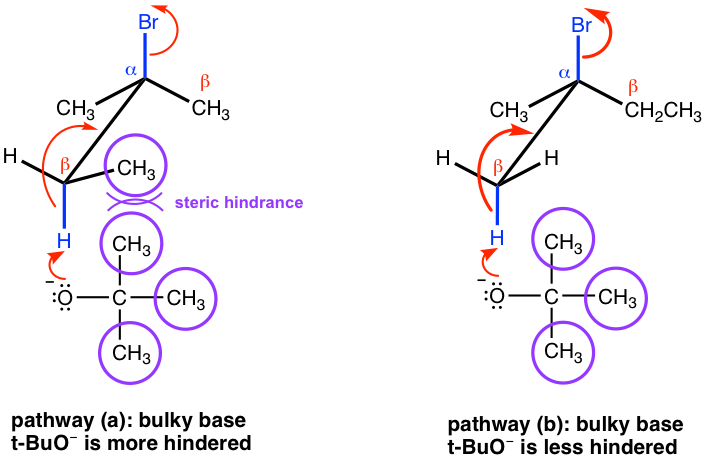
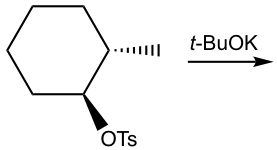
Sin embargo, si se aplica una base voluminosa en la eliminación, como t-BuOK, la reacción favorece la formación de alquenos menos sustituidos.
Esto se debe principalmente al impedimento estérico. Con t-BuO — atacando el β-hidrógeno, es difícil para esta gran base voluminosa acercarse a los hidrógenos desde el β-carbono que está unido con más sustituyentes (como se muestra en la ruta (a) a continuación), mientras que el hidrógeno del grupo metilo es mucho más fácil de acceder (en la vía (b) en su lugar. Cuando la eliminación produce el alqueno menos sustituido, se dice que sigue la regla de Hofmann.
8.1.3 Estereoquímica de la reacción E2
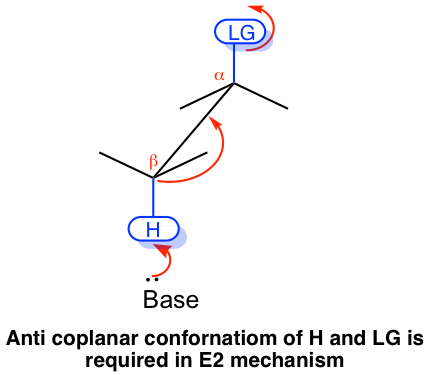
El mecanismo E2 tiene un requisito especial de estereoquímica para garantizar que continúe. Primero, el enlace conectado con el grupo lápida y el enlace conectado con el H deben estar en el mismo plano, para permitir el correcto solapamiento orbital de los dos carbonos en la formación del enlace π del producto alqueno. Segundo, el grupo de salida y H deben estar en antiposición el uno al otro. Esto se debe a que la antiposición permite que el estado de transición de la reacción esté en la conformación escalonada más estable, que ayuda a bajar el nivel de energía del estado de transición y acelerar la reacción. En general, la reacción de E2 procede con el grupo lápida y H están en conformación anticoplanar.
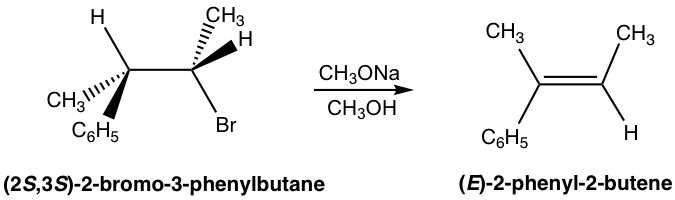
Debido al requisito de conformación anticoplanaria para la reacción E2, un estereoisómero se producirá preferiblemente sobre el otro, y esto se denomina estereoselectividad. Para el siguiente ejemplo, la eliminación de (2S ,3 S) -2-bromo-3-fenilbutano produce el isómero E específicamente, no el isómero Z en absoluto. Esto se debe a que cuando H está en anti-posición al grupo lápida Br, todo el compuesto está en conformación escalonada, y los otros grupos conservan su posición relativa en eliminación que conduce al isómero E.
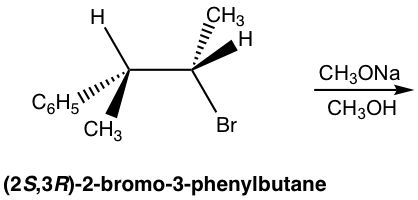
Ejercicios 8.1
8.1.4 Bases en las reacciones E2 (Breve resumen)
Las bases más comúnmente aplicadas en la reacción E2 son hidróxido OH —, y alcóxido RO —. Específicamente, la combinación de base con el alcohol correspondiente se utilizan ampliamente, tales como: CH 3 ONA/CH 3 OH, C 2 H 5 ONa/C 2 H 5 OH.
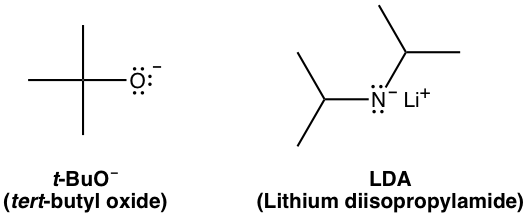
Ejemplos de bases pequeñas: OH —, CH 3 O —, C 2 H 5 O —, NH 2 —
Ejemplos de bases grandes y voluminosas: t-BuO —, LDA (diisopropilamida de litio)