10.7: Reacciones de Oxidación de Alquenos
- Page ID
- 76404
Los alquenos experimentan una serie de reacciones en las que se oxida el doble enlace C=C. Para los compuestos orgánicos, una forma convencional de determinar si se produce la oxidación o reducción es verificar el número de enlaces C—O o los enlaces C-H. Una reacción de oxidación aumenta el número de enlaces C-O o disminuye el número de enlaces C-H. Por otro lado, una reacción de reducción aumenta el número de enlaces C-H o disminuye el número de enlaces C—O. El estado relativo de oxidación de algunos grupos funcionales orgánicos comunes se enumeran aquí con base en la tendencia.
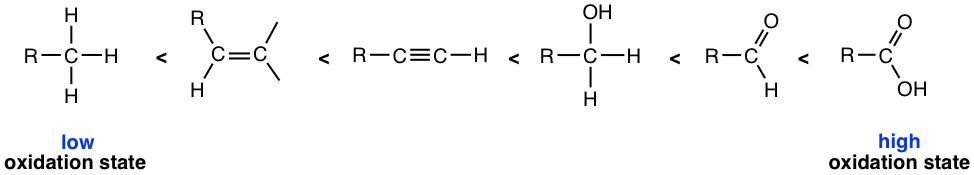
La 1,2-dihidroxilación, la conversión del doble enlace C=C en 1,2-diol, es una reacción de adición oxidativa de alqueno. El tetóxido de osmio (OSO 4) es un agente oxidante ampliamente utilizado para tal propósito. También se puede usar permanganato de potasio, aunque es propenso a producirse una mayor oxidación para escindir el diol porque es un agente oxidante más fuerte (10.7.2).
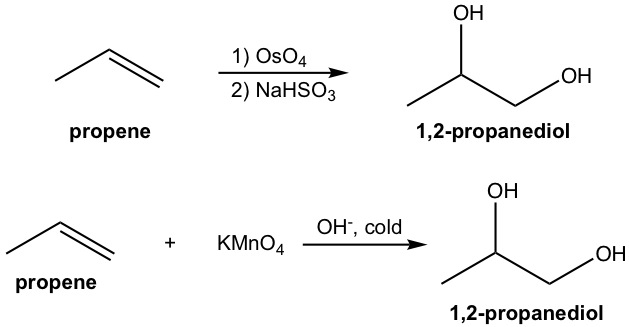
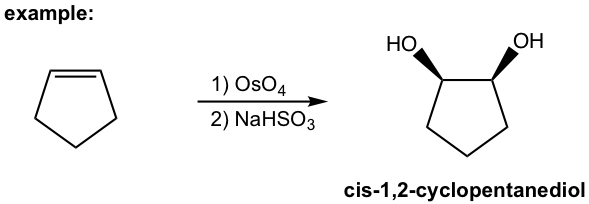
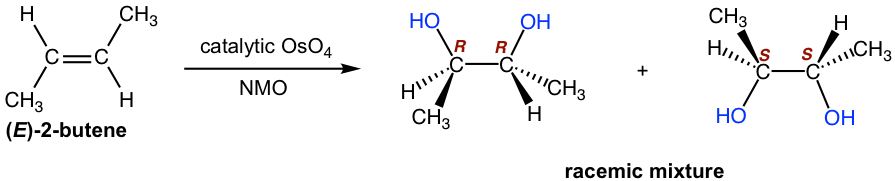
El método tradicional de 1,2-dihidroxilación con tetroóxido de osmio es un procedimiento de dos etapas. El tetóxido de osmio reacciona primero con alqueno a partir de un intermedio éster de osmato cíclico y este intermedio cíclico implica la adición sin de OsO 4 al doble enlace. La escisión del enlace O-Os del intermedio tiene lugar luego en la segunda etapa con el agente reductor NaHSO 3, sin modificar la estereoquímica del enlace C-O. Por lo tanto, el diol formado tiene la propiedad estereoquímica syn.

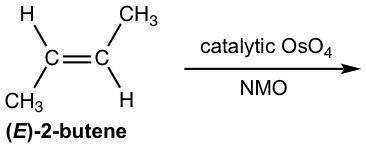
1,2-Dihidroxilación catalítica de OSO 4
La 1,2-dihidroxilación con tetroxido de osmio es una reacción efectiva que se utiliza muy a menudo en los laboratorios para la preparación de diol a partir de alqueno. Sin embargo, este método tiene importantes inconvenientes debido a que el tetóxido de osmio es un reactivo altamente tóxico, volátil y costoso. Se han desarrollado métodos mejorados que permiten que solo se use una cantidad catalítica de OsO 4 junto con un co-oxidante en cantidad estequiométrica. El N-óxido de N-metilmorfolina (NMO) es uno de los co-oxidantes más empleados. En tal condición, los compuestos de osmio son re-oxidados por NMO y pueden ser reutilizados para reaccionar con más alquenos, por lo que solo es necesario un pequeño porcentaje molar de OsO 4 en la mezcla de reacción. La reacción transcurre suavemente con syn dioles producidos con buen rendimiento.

En cuanto a la estereoquímica del producto, aunque la adición sin podría ocurrir a ambos lados del plano alqueno, eso da el mismo producto que es el compuesto meso. Esto se puede identificar ya sea buscando el plano de simetría del producto, o asignando la configuración absoluta sobre los centros de quiralidad. Revisar los conocimientos de estereoquímica.
Ejemplos
Solución:
La adición sin ocurre a ambos lados del plano alqueno, por lo que ambos enantiómeros se obtienen con la misma cantidad que la mezcla racémica.
10.7.2 Escisión oxidativa de alquenos
Esciplamiento con ozono
Con el agente oxidante más fuerte que se aplica, el doble enlace C=C de los alquenos se puede escindir oxidativamente, y la molécula de alqueno se escinde en moléculas más pequeñas.
La forma más efectiva de escindir alqueno es usar ozono, O 3, mediante un proceso de dos etapas. El alqueno se hace reaccionar primero con ozono a muy baja temperatura (-78 °C) y luego se trata con sulfuro de dimetilo, (CH 3) 2 S, (o Zn/CH 3 COOH) para dar los productos de escisión. Todo el proceso se llama ozonólisis.
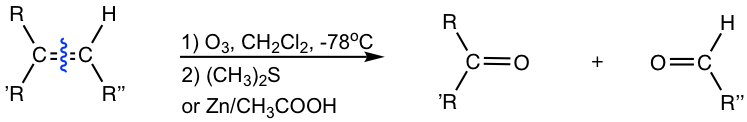
La ozonólisis da como resultado la escisión del doble enlace, y cada carbono de doble enlace se une a un átomo de oxígeno con un nuevo doble enlace. Los productos de ozonólisis son aldehído (s) y/o cetona (s), y las estructuras exactas de los productos dependen de la estructura del alqueno inicial:
- Los carbonos de alqueno disustituidos se escinden oxidativamente a cetona;
- Los carbonos de alqueno monosustituidos se escinden oxidativamente a aldehído;
- Los carbonos alquenos no sustituidos se escinden oxidativamente a formaldehído (HCHO).
Ejemplos
Mostrar productos de ozonólisis de las siguientes reacciones:
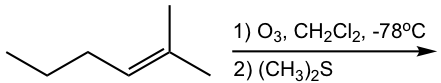
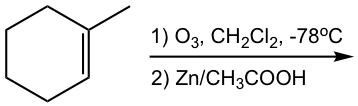
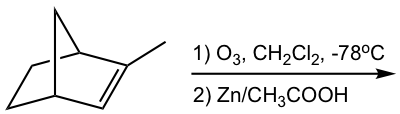
Pista: Para averiguar la estructura del producto (s) de ozonólisis, “corta” el doble enlace, luego “agrega” un “=O” (oxígeno de doble enlace) a cada carbono.
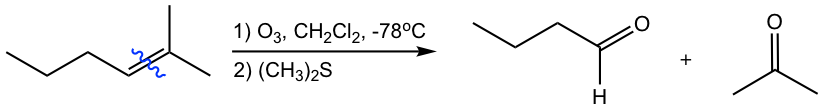
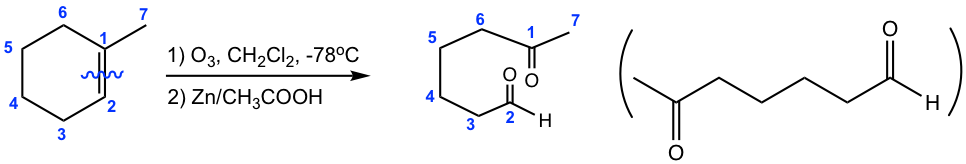
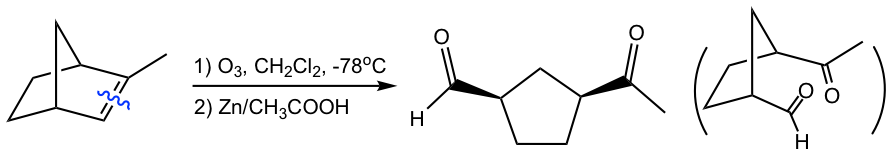
Como se muestra con los ejemplos anteriores, la reacción de ozonólisis es útil como herramienta sintética para ciertos aldehídos y cetonas. En tanto, también es un método para determinar la posición de los dobles enlaces en un alqueno al trabajar hacia atrás desde la estructura de los productos.
Ejemplos
Determinar la estructura del alqueno:
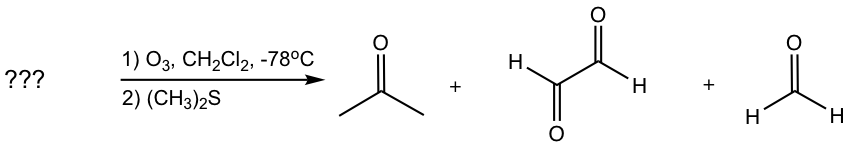
Enfoque: Para determinar la estructura del alqueno inicial, podemos trabajar hacia atrás conectando dos enlaces C=O en los productos juntos. Los dos enlaces C=O están “conectados” para dar un enlace C=C con todos los átomos de oxígeno “eliminados”. En este ejemplo, los dos enlaces C=O azules dan el enlace C=C azul, y los dos enlaces C=O rojos dan el enlace rojo C=C.
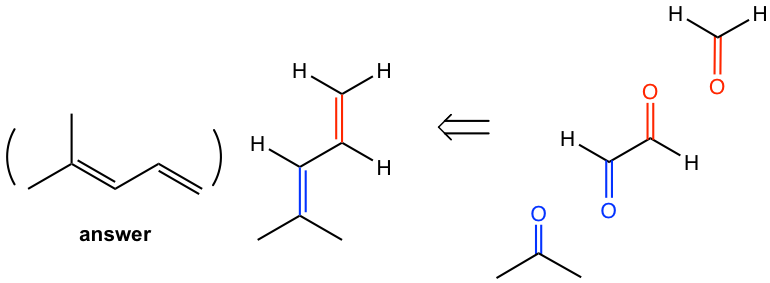
Mecanismo para Ozonólisis
Los indicios mencionados anteriormente son para ayudarnos a resolver los problemas con la reacción de ozonólisis, no el mecanismo de reacción. El mecanismo de reacción de ozonólisis es bastante complejo que implica la formación de ozónido cíclico inicial que se descompone en fragmentos, y el fragmento se recombina para formar un nuevo ozónido cíclico, el cual se reduce para dar productos.
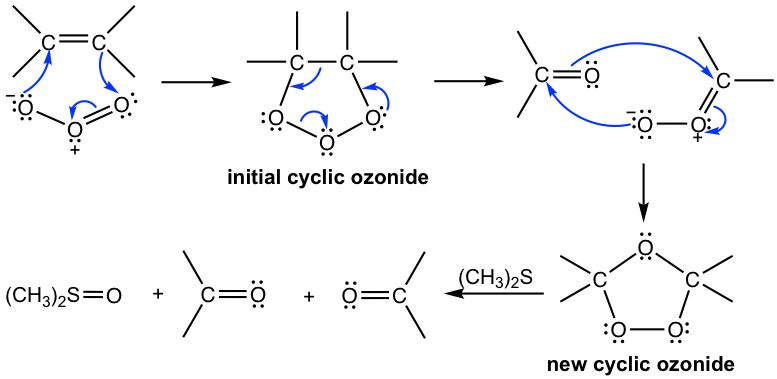
Desdoblamiento con Permanganato de Potasio KMnO
El permanganato de potasio, KMnO 4, es otro agente oxidante que escinde el doble enlace C=C de un alqueno. Bajo condiciones básicas calientes, los productos de escisión oxidativa de los alquenos podrían involucrar cetona, sal de ácido carboxílico o dióxido de carbono dependiendo de los diferentes patrones de sustituyentes en el alqueno:
- Los carbonos de alqueno disustituidos se escinden oxidativamente a cetona;
- Los carbonos de alqueno monosustituidos se escinden oxidativamente al ácido carboxílico (en formato de sal);
- Los carbonos alquenos no sustituidos se escinden oxidativamente a CO 2 y H 2 O.
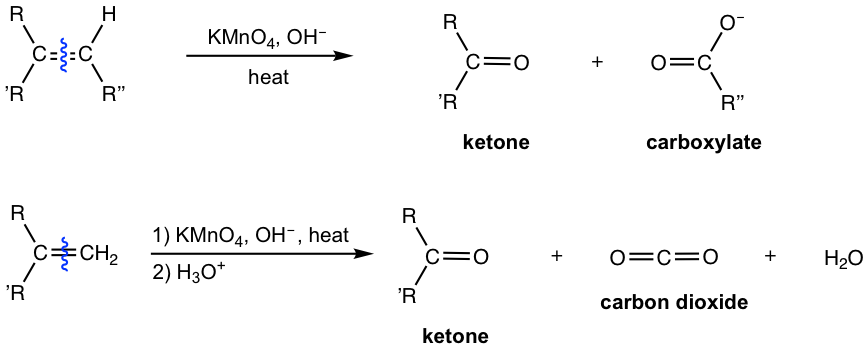
El KMnO 4 es un agente oxidante más fuerte que oxida aún más los productos de escisión iniciales, por lo tanto, el aldehído se oxida adicionalmente a ácido carboxílico (en formato de sal en condiciones básicas). Para los carbonos alquenos no sustituidos terminales, el producto inicial es HCHO, que luego se oxida adicionalmente a carboxilato CO 3 2- en condiciones básicas. La acidificación de CO 3 2- produce H 2 CO 3 que se descompone a CO 2 y H 2 O. Debido a la sobreoxidación, KMnO 4 no es el reactivo útil para la síntesis de aldehído/cetona a partir de alquenos.


