10.6: Otras dos reacciones de hidratación de alquenos
- Page ID
- 76417
Como aprendimos en la sección 10.2.2, la hidratación catalizada por ácido (adición de agua) al alqueno produce alcohol que sigue la regioselectividad de Markovnikov. Aquí investigaremos otros dos métodos para la hidratación del alqueno, a través de diferentes condiciones de reacción y mecanismo, y produciremos ya sea Markovnikov o producto alcohólico anti- Markovnikov respectivamente.
10.6.1 Oximercuración — Desmercuración de alquenos La oximercuración-desmercura de alquenos proporciona una forma alternativa de sintetizar el alcohol de Markovnikov a partir del alqueno. Es una reacción rápida con aplicación de lotes en laboratorios, y el rendimiento suele ser superior al 90% .Comparando con la hidratación catalizada por ácido, los beneficios de la oximercuración-desmercura son: no se requieren ácidos fuertes y no implica reordenamientos de carbocationes. La única razón que limita la amplia aplicación de este método es la preocupación ambiental ya que se producen residuos de mercurio (Hg).La oximercuración-desmercuración es un procedimiento de dos pasos, como se muestra explícitamente a continuación:
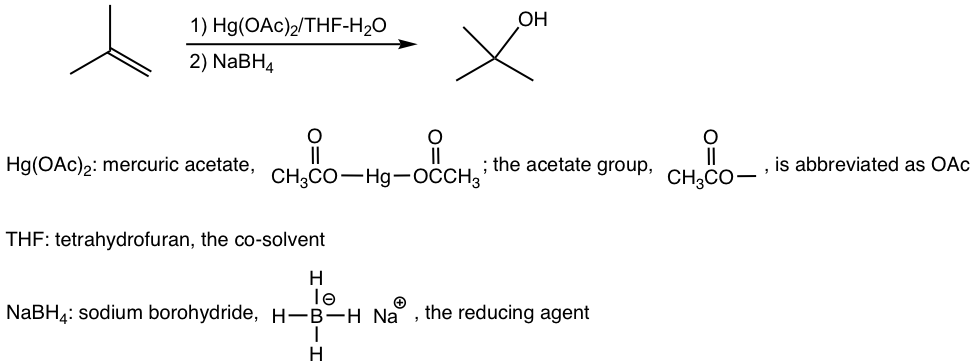
El mecanismo en la etapa de oximercuración implica un mercurio que actúa como reactivo que ataca el doble enlace alqueno para formar un intermedio de ion mercurinio cíclico. Debido a que no interviene ningún intermedio de carbocatión, no se observan reordenamientos en dicha reacción. Luego una molécula de agua ataca el carbono más sustituido para abrir el puente de iones de mercurio, seguido de la transferencia de protones a la molécula de agua solvente. Por el mismo razonamiento de que la molécula de agua ataca al carbono más sustituido del ion halonio cíclico en la formación de halohidrina (sección 10.2.4), la molécula de agua en este mecanismo también ataca preferentemente al carbono más sustituido, ya que la carga positiva parcial se acomoda mejor en un carbono terciario que en un carbono primario (si el ataque ocurre en el otro carbono).

El intermedio organomercurio es luego reducido por borohidruro de sodio, el mecanismo para este paso final está más allá del alcance de nuestras discusiones aquí. Observe que el mecanismo general de oximercuración-desmercura sigue la regla de Markovnikov con el grupo OH unido al carbono más sustituido y el átomo de hidrógeno se suma al carbono menos sustituido.
10.6.2 Hidroboración — Oxidación de Alquenos
La hidroboración-oxidación es otro método para convertir alqueno en alcohol, sin embargo, en la regioselectividad anti-Markovnikov, es decir, el OH está unido al carbono con mayor número de hidrógenos y átomo de hidrógeno unido al carbono con menos hidrógenos.
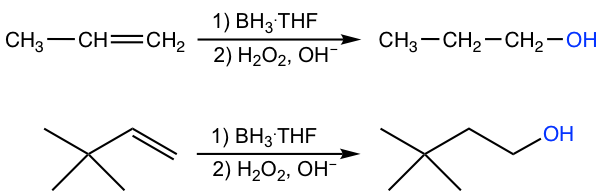
La reacción general es también un proceso de dos etapas:
- El primer paso es la hidroboración, es decir, la adición de átomo de boro y átomo de hidrógeno al alqueno.
- La segunda etapa es la oxidación e hidrólisis del alquilborano formado en la etapa 1, para producir alcohol.
El reactivo de borano utilizado en la primera etapa generalmente está disponible como la solución que contiene el complejo BH3·THF. El borano, BH3, es una especie deficiente en electrones porque el átomo de boro tiene octeto incompleto con solo seis electrones. Cuando se introduce BH3 al THF, reaccionan para formar un aducto de ácido de Leis-base de Lewis (Capítulo 3.??) , que es más estable y relativamente fácil de manejar y almacenar. La solución que contiene BH3·THF sigue siendo bastante sensible y debe ser utilizada en atmósfera inerte (nitrógeno o argón) y con cuidado.
Debido al octeto incompleto del átomo de boro en BH3, es un buen electrófilo que reacciona con alqueno. El mecanismo de la etapa de hidroboración se ilustra a continuación con propeno como ejemplo.
Mecanismo de Hidroboración
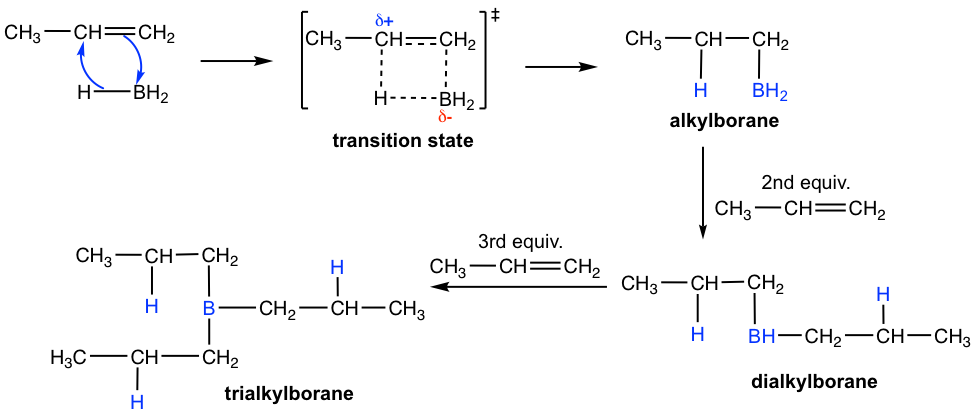
Cuando un alqueno terminal, por ejemplo propeno, se trata con BH 3 ·THF, la molécula BH 3 se añade sucesivamente al doble enlace C=C de tres moléculas de alqueno para formar un trialquilborano. En cada etapa de adición, el átomo de boro se une al carbono de doble enlace menos sustituido, y un átomo de hidrógeno se transfiere del BH 3 al carbono más sustituido. En la segunda etapa (oxidación e hidrólisis) de todo el proceso, el borano se oxida e hidroliza al grupo OH. Por lo que la regioselectividad de la etapa de hidroboración define la regioselectividad anti-Markovnikov de la reacción general.
Dicha regioselectividad de la etapa de hidroboración puede explicarse tanto por efectos electrónicos como estéricos. En cuanto al factor estérico, el grupo que contiene boro es más voluminoso que el átomo de hidrógeno, por lo que pueden acercarse más fácilmente al carbono menos sustituido. El efecto electrónico radica en la estructura del estado de transición para la formación de alquilborano. Como se muestra anteriormente, los electrones π del doble enlace se donan al orbital π del boro y se aproxima a un estado de transición cíclica de anillo de cuatro átomos. En el estado de transición, los electrones se desplazan en la dirección del átomo de boro y alejándose del carbono que no está conectado al boro. Esto hace que el carbono no conectado al boro tenga una carga positiva parcial, que se acomoda mejor en el carbono más sustituido. Como resultado, el efecto electrónico también favorece la adición de boro en el carbono menos sustituido.
Estereoquímica de la hidroboración
La hidroboración-oxidación tiene lugar con estereoquímica sin, que el grupo OH y el átomo de hidrógeno se suman al mismo lado del doble enlace, como se muestra en el siguiente ejemplo.
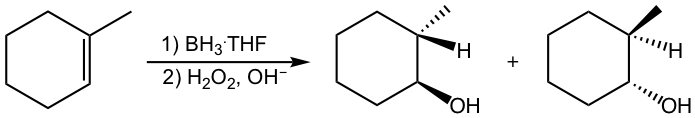
Esto puede explicarse por el mecanismo de la etapa de hidroboración. El estado de transición del anillo de cuatro miembros requiere que el átomo de boro y el átomo de hidrógeno se acerquen a la misma superficie del doble enlace alqueno, por lo que se agregan en la posición syn al doble enlace. Dado que la parte de boro se convierte en grupo OH en la segunda etapa, eso da como resultado la adición sin de OH y H en el producto.
Oxidación e hidrólisis de trialquilboranos
Al terminar la reacción de hidroboración, los trialquilboranos generalmente no se aíslan, se oxidan e hidrolizan con la adición de peróxido de hidrógeno (H 2 O 2) en solución acuosa básica. El mecanismo para la oxidación e hidrólisis de los trialquilboranos es bastante complicado y podría ser un tema opcional, el resultado neto es el boro que inicialmente unido sobre el carbono es reemplazado por el grupo hidroxi OH.
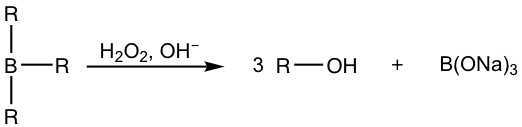
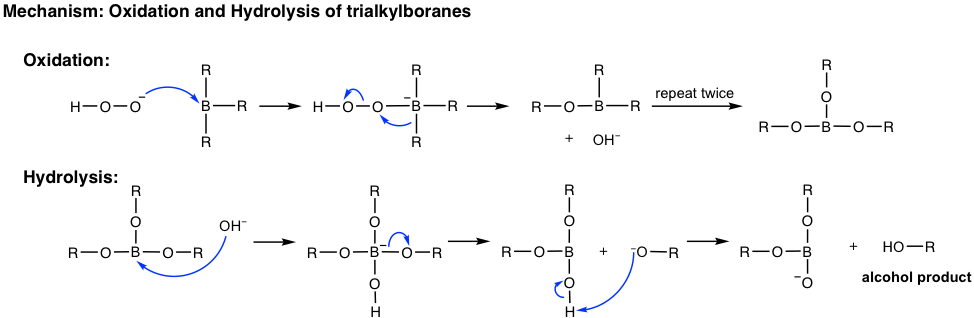
Resumen: Métodos de Hidratación de Alqueno
En general, existen tres métodos para convertir alqueno en alcohol mediante adición, son la hidratación catalizada por ácido, la oximercuración-desmercura y la hidroboración-oxidación. Cada método tiene su propio carácter con beneficio y desventaja. El método adecuado podría ser recogido en función de la necesidad.
| Hidratación catalizada por ácidos | Oximercuración-desmercuración | Hidroboración-oxidación | |
| Condiciones de Reacción | cat. H + /H 2 O | 1) Hg (OAc) 2 /THF · H 2 O 2) NaBH 4 | 1) BH 3 · THF 2) NaBH 4 |
| Regioselectividad | Markovnikov | Markovnikov | Anti-Markovnikov |
| Estereoquímica | No controlado | No controlado | adición de sincronización |
| Reordenamiento | Sí | No | No |


