9.10: RMN de compuestos fosforilados
- Page ID
- 72448
Debido a que tantas moléculas biológicas contienen grupos fosforilo, vale la pena observar cómo los científicos utilizan la RMN para determinar la estructura de estas moléculas. Recordemos de la sección 5.1 que\(^{31}P\), el isótopo de fósforo más abundante, es\(NMR\) activo: puede ser observado directamente por\(^{31}P-NMR\), e indirectamente observado en\(^1H-NMR\) y\(^{13}C-NMR\) a través de sus interacciones de espín-acoplamiento con protones y carbonos vecinos, respectivamente.
Consideremos el caso del difosfato de isopentenilo, la molécula de bloque de construcción utilizada por las células para elaborar compuestos 'isoprenoides' como el colesterol (en muchos animales) o\(\beta \) -caroteno (en algunas plantas). \(NMR\)los espectros de esta molécula se tomaron en un\(D_2O\) disolvente, tamponado con\(ND_4OD\) (el equivalente de deuterio de hidróxido amónico acuoso\(NH_4OH\)) (J. Org. Chem. 1986, 51, 4768). En nuestra discusión, los átomos de carbono se especifican con números, protones con letras minúsculas y átomos de fósforo con letras mayúsculas.
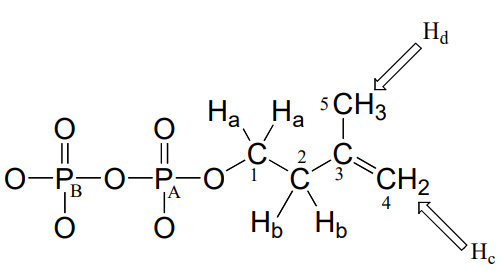
Primero, veamos el espectro de protones:
\(^1H-NMR\)
\(H_a: 4.05 ppm (t_d); ^3J_{H_a-H_b} = 6.6\)Hz;\(^3J_{H_a-P_A} = 3.3\) Hz.
\(H_b: 2.39 ppm (t) ^3J_{H_a-H_b} = 6.6\)Hz
\(H_c: 4.86 ppm (s)\)
\(H_d: 1.77 ppm (s)\)
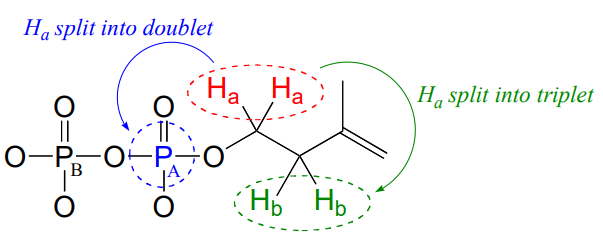
Las señales para\(H_b\),\(H_c\), y\(H_d\) parece que esperaríamos de nuestra discusión en el capítulo 5, con la excepción de Hc que se le invitará a discutir en el ejercicio a continuación. ¿Por qué, sin embargo, la señal para Ha se divide en un triplete de dobletes (td)? En primer lugar, como, era de esperar, los dos protones Hb vecinos dividieron la señal de Ha en un triplete, con 3JH-H = 6.6 Hz. Entonces, la señal se divide aún más en dobletes (\(^3J_{H-P} = 3.3\)Hz) por\( P_A\), cuanto más cerca de los dos átomos de fósforo. Un átomo de fósforo
La señal para los dos protones\(H_c\) '' en el difosfato de isopentenilo se reporta anteriormente como un singlete integrándose a\(2H\). Are these two protons really chemically equivalent, and, according to what you know about proton \(NMR\), ¿debería esta señal ser realmente un singlete? Si no, ¿qué tipo de señal (s) esperaría ver? Explica cualquier discrepancia entre lo que esperarías ver y los datos reales reportados.
Ahora, veamos el\(^{13}C\) espectro de IPP:
\(^{13}C-NMR\)(protones desacoplados)
\(C_1: 40.7 ppm (d); ^2J_{C_1-P_A} = 7.2\)Hz
\(C_2: 67.0 ppm (d); ^3J_{C_2-P_A} = 4.0\)Hz
\(C_3: 147.4 ppm\)
\(C_4: 114.6 ppm\)
\(C_5: 24.5 ppm\)
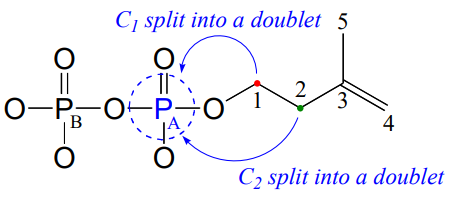
Observe que las señales para ambos\(C_1\) y\(C_2\) se dividen en dobletes por el campo magnético de\(P_A\). Los átomos de fósforo se acoplarán\(^{13}C\) giratoriamente con núcleos de hasta tres enlaces de distancia. Observe también que el acoplamiento de 2 enlaces entre\(C_1\) y\(P_A\) es mayor que el acoplamiento de 3 enlaces entre\(C_2\) y\(P_A\) (7.2 Hz vs. 4.0 Hz). Finalmente, observe que no observamos\(C-P\) acoplamiento de 4 enlaces: no\(C_3\) está acoplado por giro\(P_A\), y no\(P_B\) está acoplado a ninguno de los\(^1H\) núcleos\(^{13}C\) o núcleos de la molécula.
Recuerde que al procesar un\(^{13}C-NMR\) espectro típico, 'apagamos' electrónicamente el acoplamiento de espín entre los carbonos y los protones vecinos para simplificar el espectro (esto se conoce como 'desacoplamiento de protónes'). El desacoplamiento de protones no desactiva el acoplamiento de\(C-P\) giro.
Debido a que\(^{31}P\) es\(NMR\) -activo, también podemos, con un\(NMR\) espectrofotómetro equipado con una sonda de fósforo, observar directamente\(NMR\) las señales de fósforo, así como podemos observar directamente las señales de protones y\(^{13}C\) núcleos. En un instrumento de RMN donde los protones resuenan a 300 MHz y los\(^{13}C\) núcleos resuenan a 75 MHz, el fósforo resuena a 32 MHz. En\(^{31}P-NMR\) los experimentos, el estándar de referencia utilizado para determinar el punto de 0 ppm suele ser el ácido fosfórico (tetrametilsilano, el punto estándar de 0 ppm para\(^1H\) - y\(^{13}C-NMR\), ¡no tiene un átomo de fósforo!). El\(^{31}P-NMR\) espectro del difosfato de isopentenilo tiene, como se esperaba, dos picos, cada uno de los cuales está en la parte alta del estándar de ácido fosfórico (¡desplazamientos químicos negativos!) y se dividió en doblete (\(^2J_{P-P} = 20\)Hz) debido al acoplamiento de 2 enlaces entre los dos núcleos de fósforo.
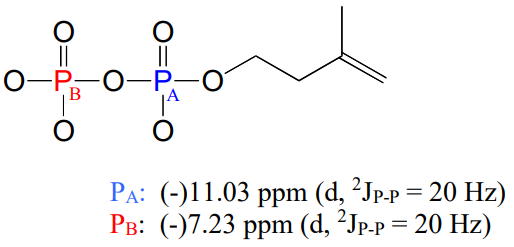
Observe que aunque las\(C_2\) señales\(C_1\) y se dividieron por\(P_A\) en nuestro\(^{13}C-NMR\) espectro, en el\(^{31}P-NMR\) espectro lo contrario no es cierto: la\(P_A\) señal no se divide por\(C_1\) o\(C_2\). Ambos carbonos son\(^{12}C\) isótopos\(NMR\) inactivos en 99 de cada 100 moléculas. Además, no se observa\(P-H\) división en este\(^{31}P\) espectro, debido a que el desacoplamiento de protones está vigente.


