2.8: Cambios Químicos y Determinaciones de Estructura Orgánica. Consideraciones Generales
- Page ID
- 78189
a. Ácido de Feist
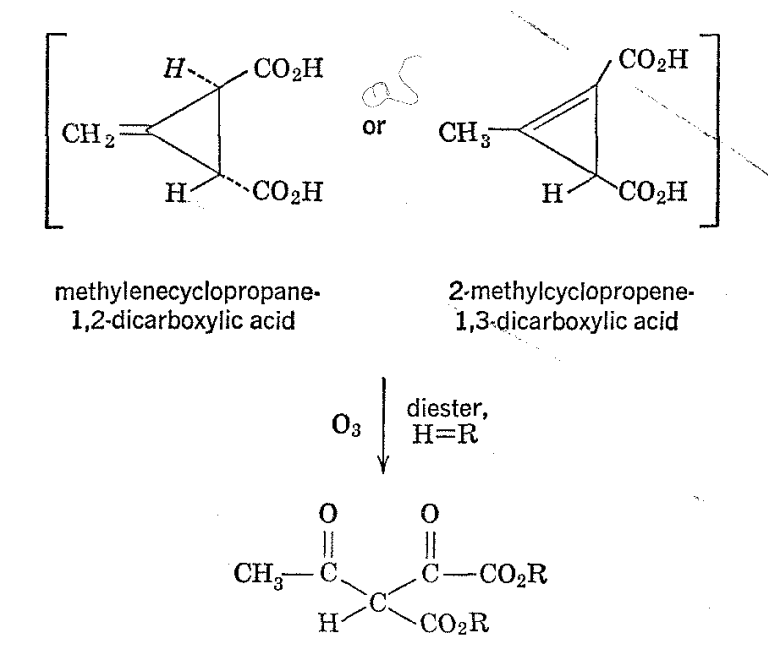
Las mediciones de desplazamientos químicos y áreas de señal pueden ser extremadamente valiosas en la determinación de estructuras tanto de moléculas simples como complicadas. Un ejemplo es el ácido de Feist, originalmente postulado por Thorpe y sus compañeros de trabajo, 13 como un ácido metilciclopropenodicarboxílico sobre la base de evidencia química, particularmente, la ozonización del éster dietílico, que no dio formaldehído sino solo una sustancia que tiene propiedades apropiadas al dietilo oxaloacetoacetato. Posteriormente, Ettlinger 14 mostró que una estructura más probable para el ácido de Feist era el ácido trans-3-metilenociclopropano-1,2-dicarboxílico.
El ácido de Feist es un sólido de alto punto de fusión y los espectros satisfactorios de alta resolución generalmente se pueden obtener solo con líquidos o soluciones no viscosos. Esto se debe a que en materiales sólidos o viscosos, los efectos magnéticos intermoleculares de los diversos núcleos magnéticos entre sí son sustanciales y producen variaciones locales en el campo magnético total. Estos dan como resultado una dispersión de frecuencias de precesión incluso para núcleos del mismo tipo químico, y tal propagación en las frecuencias de precesión provoca un ensanchamiento de línea. En un líquido no viscoso, las moléculas se tambalean una y otra vez a una velocidad rápida y el eflecto de núcleos magnéticos en una molécula en las frecuencias de precesión de núcleos en otra molécula se promedia a cero.
La elección de un disolvente adecuado para la determinación de los espectros de RMN del ácido de Feist o sustancias similares ilustra varios puntos de importancia práctica. Idealmente, el disolvente no tendría absorción de resonancia propia o de lo contrario solo una sola línea tal como podría servir como punto de calibración. El tetracloruro de carbono y el disulfuro de carbono son solventes orgánicos no hidrógenos comunes en los que, desafortunadamente, la mayoría de los compuestos orgánicos polares tienen solo una solubilidad limitada. Hay varias sustancias disponibles con una sola absorción de protones, como cloroformo, acetona, benceno, ciclohexano, dimetilsulfóxido, dioxano y agua, que cubren muy bien el rango entre disolventes polares y no polares. Sin embargo, incluso con estos disolventes, si la muestra es solo parcialmente soluble, el aumento en la sensibilidad del receptor necesario para obtener una señal medible puede producir un pico de disolvente problemático, grande y amplio. Esto se puede evitar usando disolventes deuterados adecuadamente, y muchos de estos, tales como deuterocloroformo, benceno, ácido acético, acetona y, por supuesto, agua pesada, están disponibles comercialmente. En general, las soluciones concentradas son deseables para dar una buena relación señal-ruido y para disminuir la importancia de las señales debido a las impurezas del disolvente.
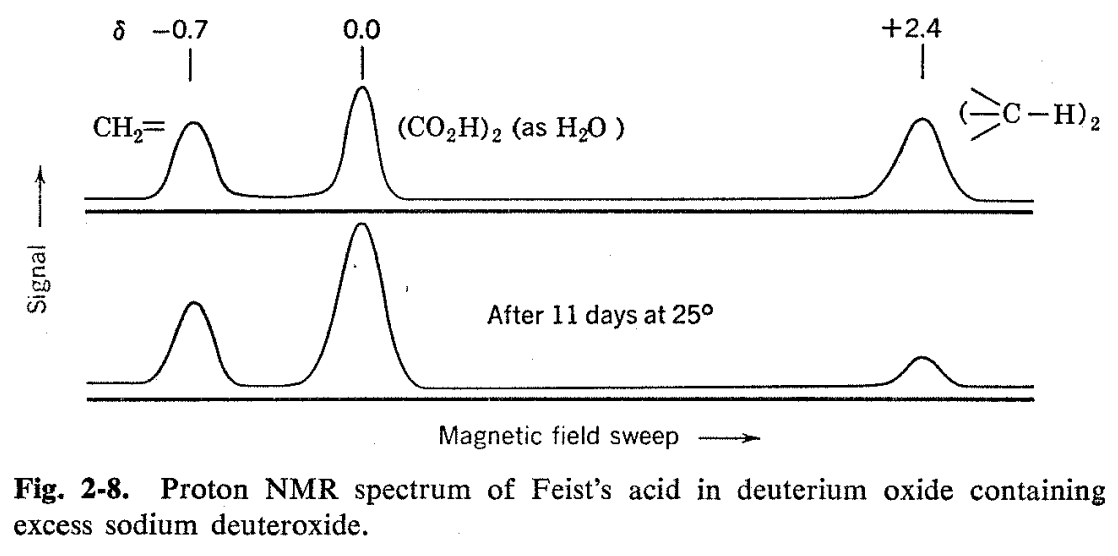
Se encontró que el espectro de resonancia de protones del ácido de Feist se midió de manera más conveniente con la sustancia en forma de la sal de sodio obtenida por disolución en solución de deuteróxido de sodio-óxido de deuterio. 15 El uso de D 2 O evitó un fuerte pico de agua y, además, dio un pico de calibración conveniente para el espectro, debido a que un pico de agua de dos proton (o HDO) resulta de la neutralización de los dos grupos carboxilo del ácido. Como se verá en las figuras 2-8, se observan otras dos resonancias de hidrógeno. Uno de estos aparece en la región del hidrógeno vinil como lo demuestra su\(\delta\) valor de -0.7 X 10 6, mientras que el otro viene con una intensidad de campo mucho mayor (\(\delta\)= +2.4 X l0 6). Las áreas de los tres picos son aproximadamente las mismas, lo que indica que eack corresponde a dos protones. El espectro de RMN del ácido de Feist es decisivo con respecto a la elección entre las estructuras de Thorpe y Ettlinger. La estructura de Ettlinger está completamente de acuerdo con el espectro observado, mientras que la estructura de Thorpe requeriría resonancias de hidrógeno de metilo alifático y anillo alicíclico en campos altos en la proporción de 3:1 y sin resonancia de hidrógeno vinílico.
El estudio del ácido de Feist dio una observación bonus en que los picos de agua de la solución de deuteróxido de sodio (que contenía algún exceso de deuteróxido de sodio) aumentaron al reposar a temperatura ambiente mientras que los picos de hidrógeno alicíclico disminuyeron (ver Fig. 2-8). Esto demuestra que los hidrógenos alifáticos pero no los hidrógenos vinílicos intercambiaron lentamente con la solución de deuteróxido de sodio-óxido de deuterio a temperatura ambiente y, además, demuestra que el ácido de Feist no se encuentra en rápido equilibrio en estas condiciones con moléculas que tienen el ácido metilciclopropenodicarboxílico estructura porque, en ese caso, los hidrógenos vinílicos también se intercambiarían.
Ettlinger 16 ha utilizado la misma técnica para demostrar que el intercambio de los hidrógenos vinílicos ocurre a temperaturas más altas, y esta es la primera evidencia de que las moléculas con la estructura de Thorpe pueden formarse en absoluto.
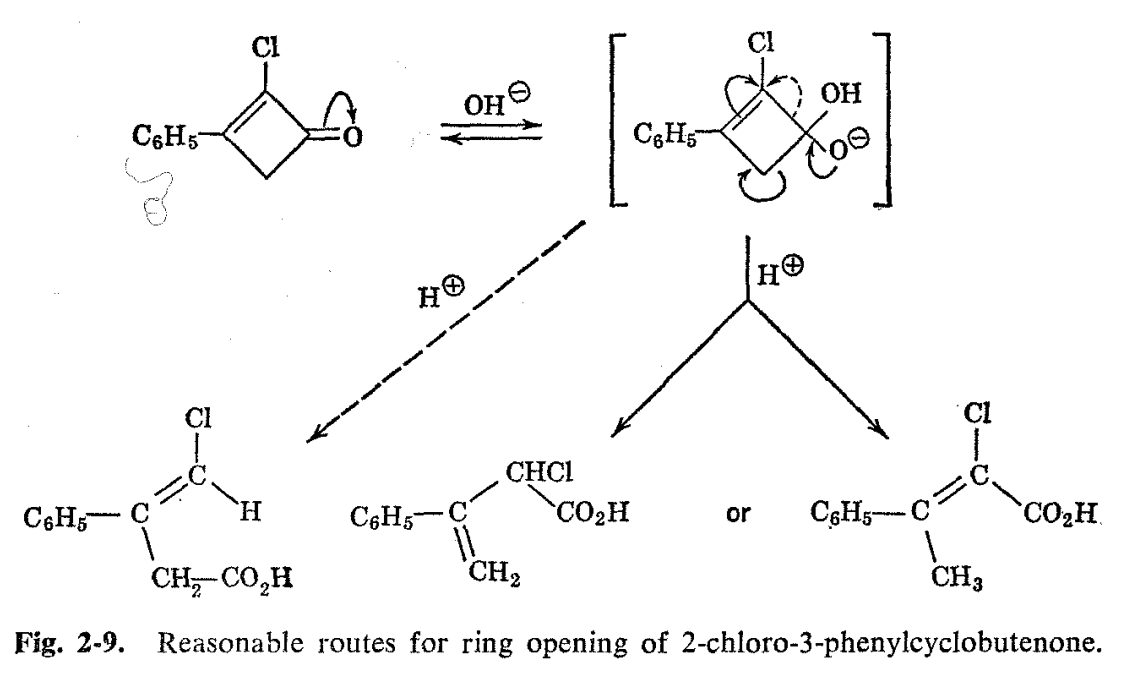
b. Reacción de apertura de anillo de 2-cloro-3-fenilciclobutenona
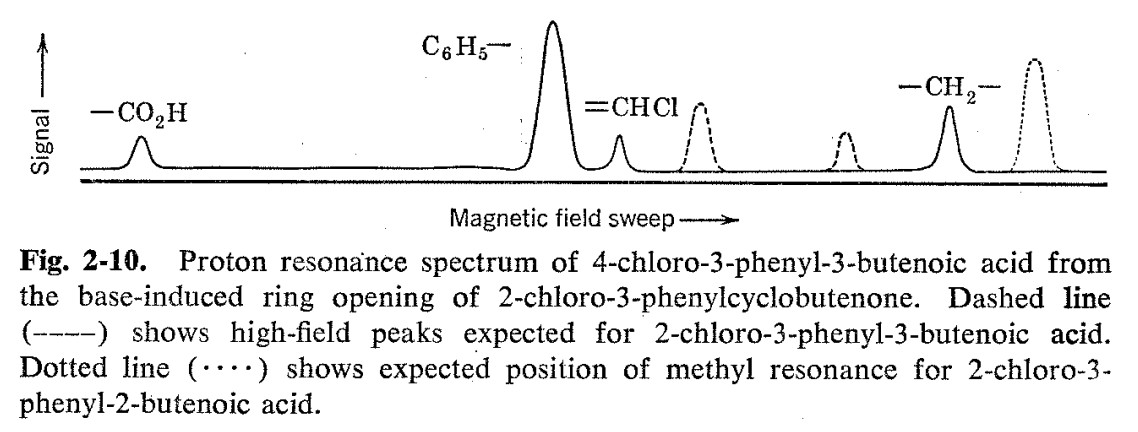
Otra prueba de estructura que utiliza los mismos principios implica el ácido fenilclorobutenoico formado a partir de la apertura del anillo de 2-cloro-3-fenilciclobutenona con hidróxido de sodio. 17 Se pueden escribir mecanismos razonables que conduzcan a tres ácidos isoméricos para esta reacción, y a priori se podría esperar que se favoreciera la formación del isómero conjugado ácido 2-cloro-3-fenilbutenoico (ver Fig. 2-9). El espectro de RMN (Fig. 2-10) del producto de reacción indica lo contrario. Además de las resonancias de hidrógeno de carboxilo y fenilo que serían comunes a las tres estructuras razonablemente esperadas, hay otros dos picos en la relación de 1:2. La resonancia de un hidrógeno ocurre en la región de hidrógeno vinílico, mientras que la resonancia de dos hidrógeno se encuentra en campos algo más bajos que un hidrógeno alifático normal. Se concluye así que el producto es ácido 4-cloro-3-fenil-3-butenoico formado al romper el anillo de ciclobutenona entre las posiciones 1 y 2. Se descarta la estructura esperada a priori, ya que no mostraría hidrógenos vinílicos y una simple resonancia de metilo de tres hidrógeno en la región del hidrógeno alifático. Las posiciones de las líneas por sí solas no sirven para descartar como posibilidad el ácido 2-cloro-3-fenil-3-butenoico, ya que tiene los hidrógenos de tipo vinilo y alifático, pero las relaciones de líneas de resonancia de campo alta a baja para este compuesto se revertirían de lo que realmente se observa.
c. Estructuras Orgánicas Complejas
El uso de la resonancia magnética nuclear puede extenderse de manera rentable incluso a sustancias naturales bastante complejas. Un ejemplo tomado de la química de los esteroides es el cetol tetracíclico obtenido por Johnson y sus compañeros de trabajo 18 por medio de una condensación aldólica y se le asignó la estructura que se muestra a continuación en virtud de su conversión a través de la acción de base fuerte y luego por una larga secuencia de etapas sintéticas a hormonas esteroidales que ocurren.
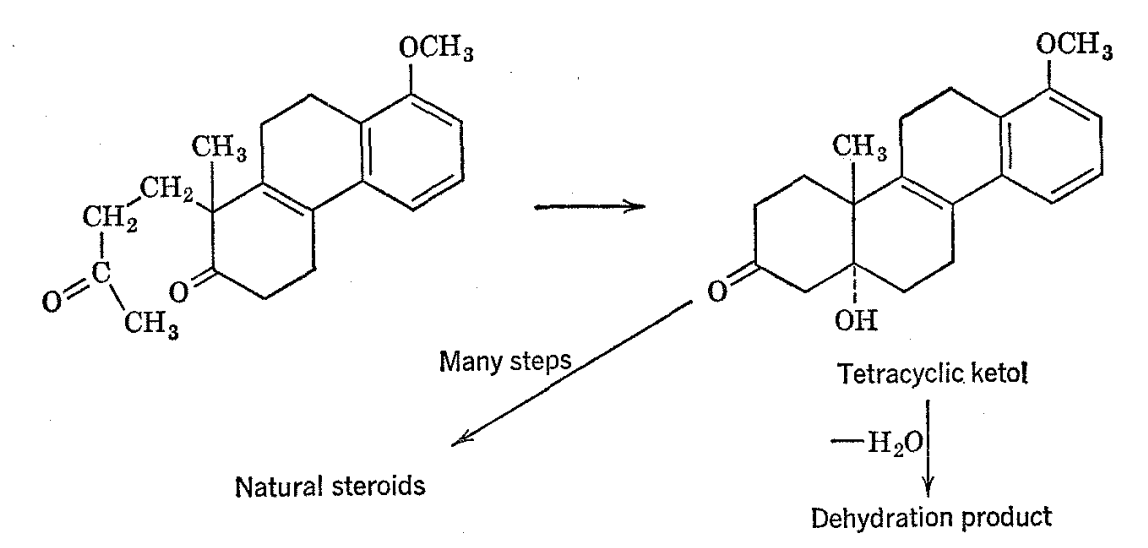
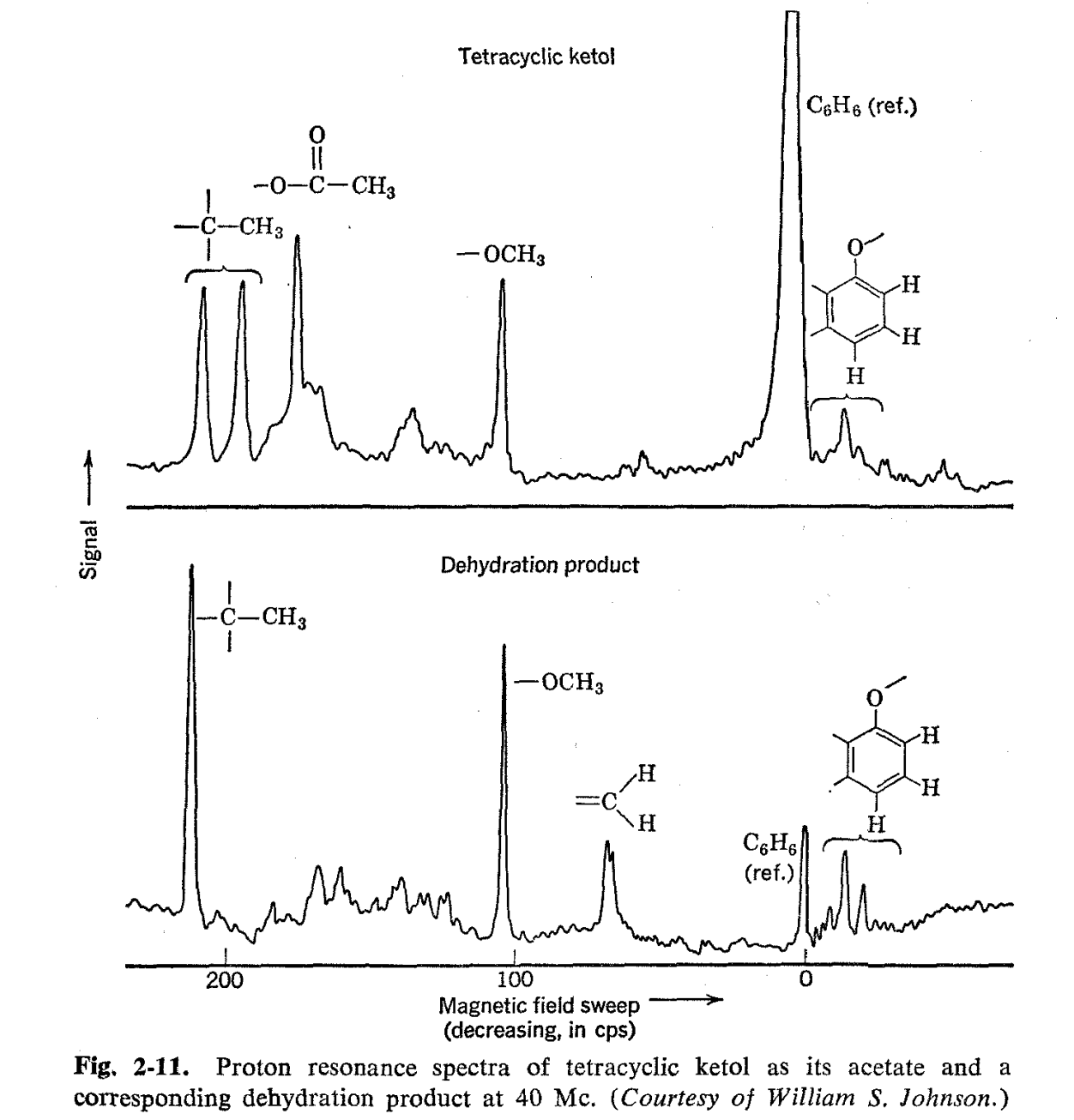
Se encontró que un producto de deshidratación derivado del ltetol tenía propiedades químicas y físicas difíciles de conciliar con la estructura dada del material de partida. Los espectros de RMN del cetol (como el acetato) y su producto de deshidratación se muestran en la Fig. 2-1 1 con la mayoría de las líneas de resonancia principales identificadas como pertenecientes a las diversas entidades estructurales. Hay dos líneas prominentes en el espectro del cetol las cuales son de la altura y posición apropiadas para corresponder a los grupos C-CH 3. Sin embargo, solo se espera una absorción de este tipo sobre la base de la estructura postulada para el cetol. Es interesante que uno de los grupos C-CH 3 desaparece al deshidratarse.
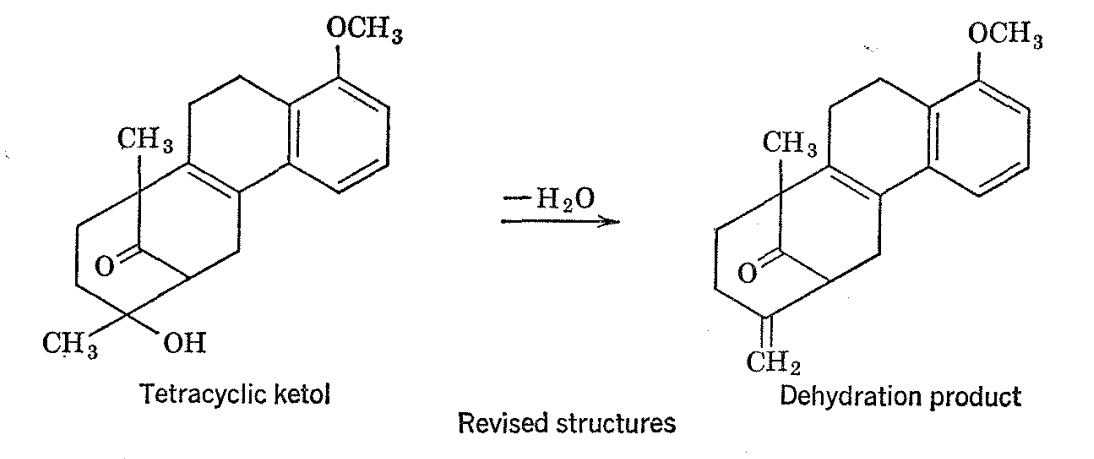
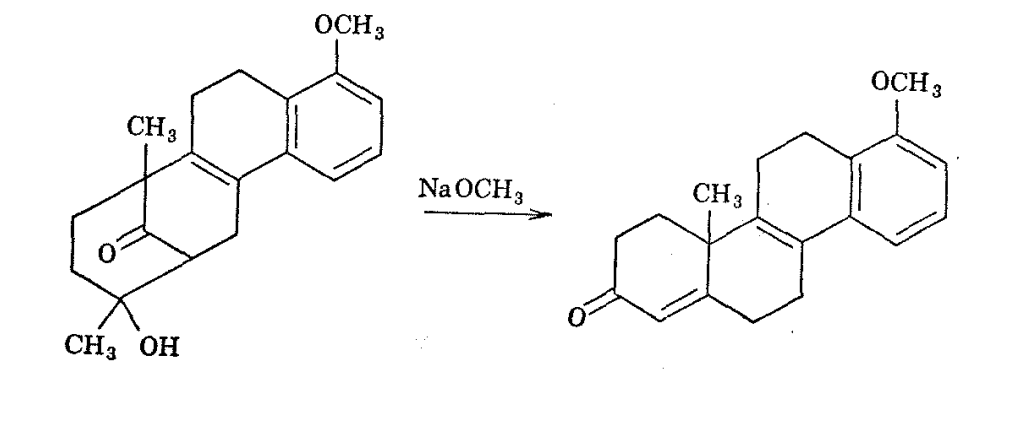
La reevaluación de la estructura del cetol sobre la base de sus espectros de RMN ha indicado que éste y su producto de deshidratación están mejor formulados como se muestra anteriormente. 19 La síntesis de hormonas esteroideas naturales a partir del cetol es posible porque la apertura del anillo, la recirculación y la deshidratación ocurren bajo la influencia de una base fuerte.
Los espectros de resonancia magnética nuclear de un gran número de compuestos esteroideos han sido analizados por Shoolery y Rogers. 20 Se observaron diferencias interesantes de aproximadamente 20 cps entre los protones axiales y ecuatoriales en las posiciones 3 y 11 del esqueleto de carbono esteroideo.
Otro ejemplo elegante del uso de datos de RMN para la elucidación de estructuras orgánicas complejas lo proporciona el trabajo de van Tamelen 21 sobre ácido fotosantónico. Aquí, un hallazgo clave fue la resonancia vinil-protónica que no pudo ser acomodada por la mayoría de las estructuras propuestas. El espectro se discutirá más a fondo en el capítulo 3 en relación con la división spin-spin, ya que, además de su desplazamiento químico característico, la resonancia de protones vinílicos mostró otras características que dan fuerte soporte a la estructura de van Tamelen para el ácido fotosantónico.
13 F. R. GOSS, C. K. Ing~ld, y J. F. Thorpe, J. Clzem. Soc., 123, 327 (1923).
14 M. G. Ettlinger, J. Am. Chem. Soc., 74, 5805 (1952).
15 A. T. Bottini y J. D. Roberts, J. Org. Chem., 21, 1169 (1956).
16 M. G. Ettlinger y F. Kennedy, Chem. Y Znd. (Londres), 891 (1957).
17 E. F. Platero, Y. Kitahara, M. C. Caserio, y J. D. Roberts, 3. Am. Chem. Soc., 80, 5840 (1958).
18 W. S. Johnson y sus compañeros de trabajo, J. Am. Chem. Soc., 78, 6302 (1956).
19 Comunicación privada de W. S. Johnson.
20 J. N. Shoolery y M. T. Rogers, I. Am. Chem. Soc., 80, 5121 (1958).
21 E. E. van Tamelen, S. H. Levin, G. Brenner, J. Wolinsky, y P. Aldrich, J. Am. Chem. Soc., 80, 501 (1958).


