4.1: Introducción. Intercambio de protones en mezclas agua-ácido acético
- Page ID
- 78242
Una de las aplicaciones más importantes de la espectroscopia de RMN es la determinación de la cinética de reacciones muy rápidas. Obviamente, la cinética de reacción podría ser seguida por la medición de las tasas de aumento o disminución de las señales de resonancia atribuibles a productos o reactivos. Sin embargo, existe un método de RMN muy simple y mucho menos convencional para la determinación de las velocidades de reacción que cubre un intervalo de constantes de velocidad y tipos de reacción extremadamente difíciles de medir de cualquier otra manera.
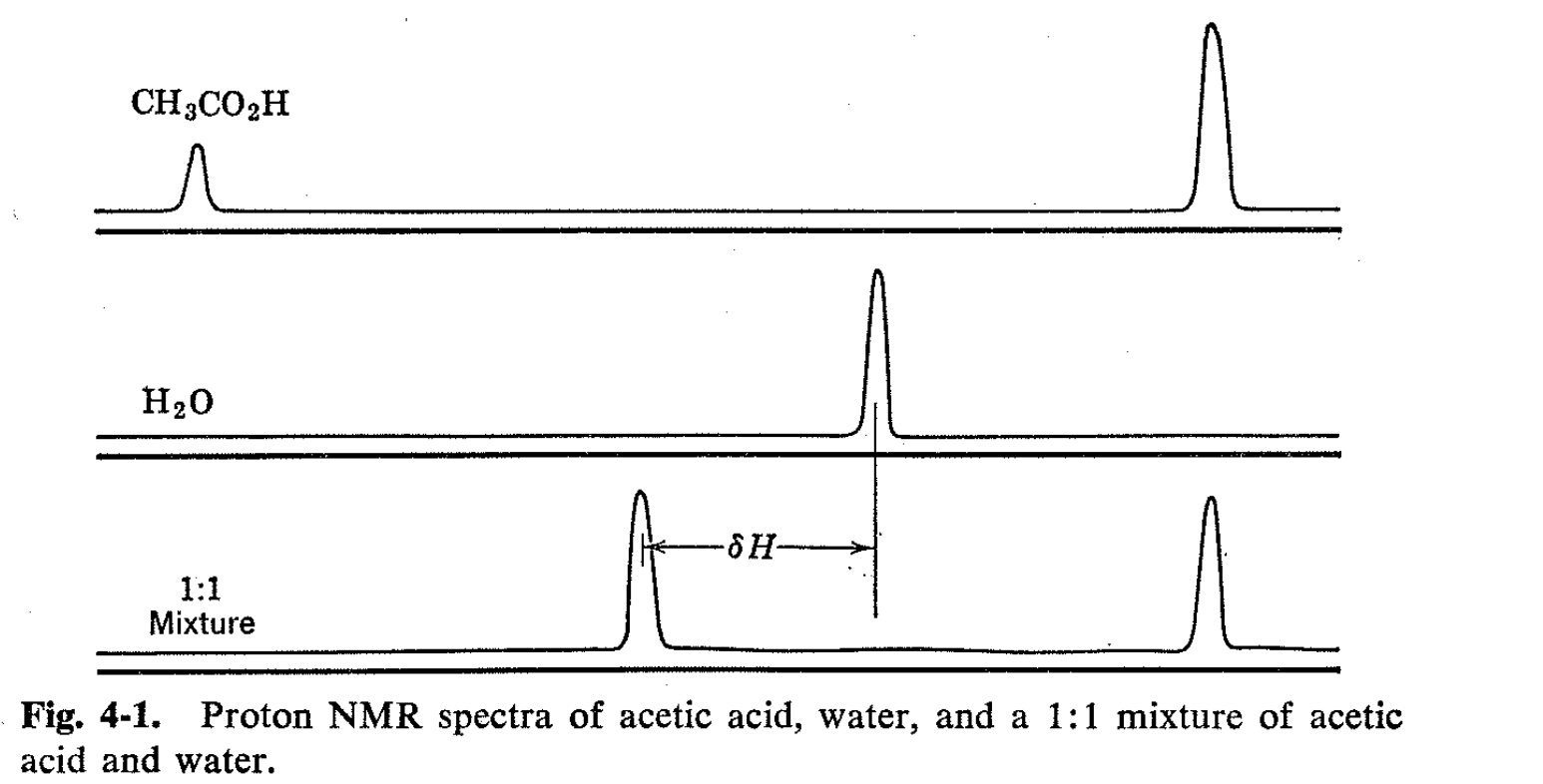
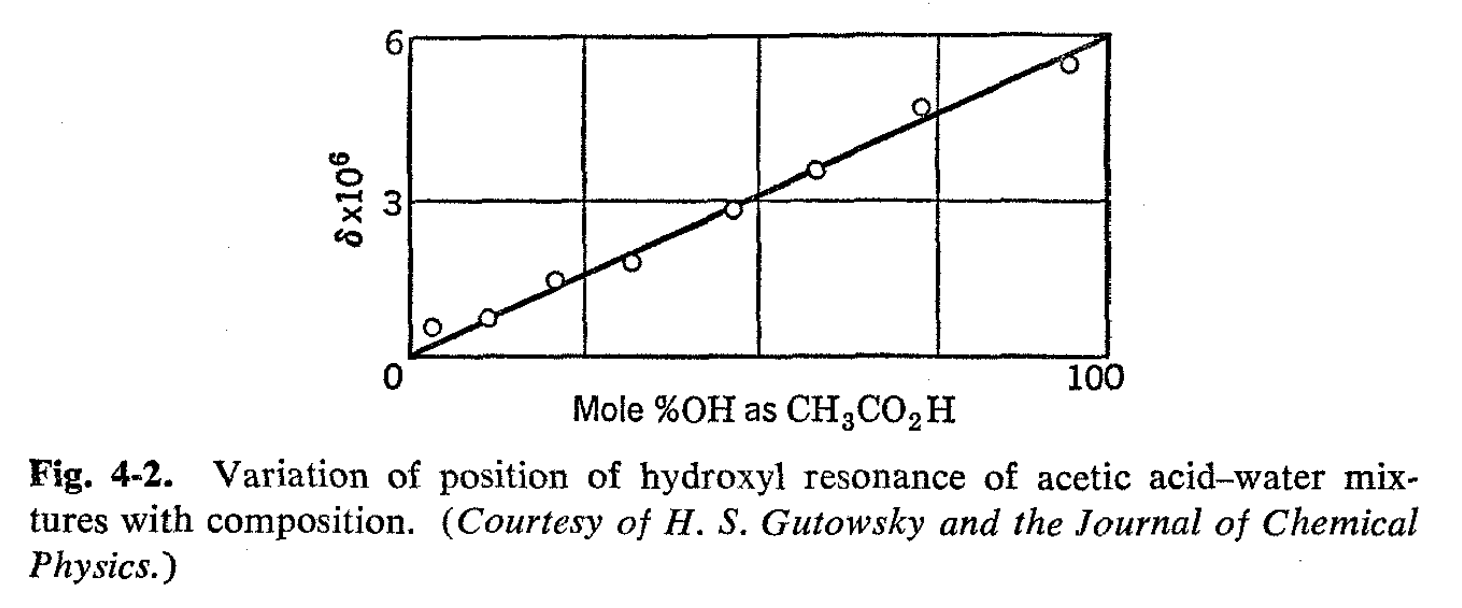
Como introducción, consideramos los espectros de RMN de soluciones de ácido acético y agua. Los espectros de las dos sustancias separadas se muestran en la Fig. 4-1, apareciendo el hidrógeno carboxilo del ácido acético en un campo muy bajo comparado con el agua y el grupo metilo en un campo considerablemente mayor. Cuando se mezclan las sustancias, se podría esperar que el espectro muestre tres líneas, una para el grupo metilo y otras dos correspondientes a las dos variedades de hidrógeno hidroxílico. Esta predicción se ve fortalecida por el conocimiento de que una variedad de métodos físicos muestran que el ácido acético en el agua está casi completamente disociado. Sin embargo, la simple expectativa no se realiza. Las mezclas de ácido acético y agua muestran solo dos líneas: una resonancia de metilo y una resonancia de hidroxilo, la última de las cuales es intermedia entre las posiciones normales de las resonancias de protones carboxilo y agua. La posición de esta resonancia de hidroxilo depende de las concentraciones, y de hecho, se ha demostrado una relación lineal entre la posición de la línea y la fracción de los protones hidroxilo en forma de ácido acético, como se muestra en la Fig. 4-2. 1 Este resultado es de considerable interés práctico ya que proporciona un medio de análisis en virtud de mediciones de posiciones de línea más que de áreas de línea. Este tipo de análisis de RMN es muy ventajoso cuando es aplicable porque las posiciones de las líneas se miden con mucha más facilidad y precisión que las intensidades de resonancia integradas.
Además de las aplicaciones al análisis, la ocurrencia de una posición promedio de la línea de resonancia de hidroxilo de dos especies químicamente diferentes de protones hidroxilo es de considerable importancia teórica. La línea de hidroxilo simple es consecuencia del rápido intercambio químico entre los hidrógenos hidroxílicos del ácido acético y el agua. Representa los protones hidroxilo en un ambiente promediado en el tiempo. Tal fenómeno es casi impensable para cualquiera criado exclusivamente en espectroscopía visible y ultravioleta. En efecto, el principio Franck-Condon establece que el tiempo de transición para una excitación electrónica resultante de la absorción de radiación electromagnética ultravioleta o visible es corto incluso comparado con la velocidad a la que los átomos vibran en enlaces químicos. Sin embargo, en la espectroscopia de RMN, los tiempos de transición para la excitación de los núcleos a estados magnéticos de mayor energía no solo son largos con respecto a las velocidades de vibración de los átomos en los enlaces sino que también son largos con respecto a las rotaciones alrededor de los enlaces simples e incluso son largos con respecto a las reacciones químicas rápidas. En efecto, el espectrómetro de RMN actúa como una cámara con una velocidad de obturación lenta y así registra moléculas en un estado promedio tomadas durante los períodos de tiempo relativamente largos requeridos para las transiciones de núcleos de un estado cuántico magnético a otro. Los largos tiempos de transición están asociados con el hecho de que estas transiciones magnéticas son inducidas por radiaciones de muy baja frecuencia comparadas con las frecuencias de luz ultravioleta y visible.
El intercambio de protones hidroxílicos de ácido acético y agua parece ser siempre demasiado rápido para dar cualquier cosa que no sea una línea de resonancia de hidroxilo promedio. Con otras sustancias, no siempre es así, y como se verá más adelante, se pueden obtener absorciones de hidroxilo separadas con mezclas de algunos compuestos hidroxílicos.
1 H. S. Gutowsky y A. Saika, J. Chem. Phys., 211, 1688 (1954).


