7.8: Bonos Sigma y Pi
- Page ID
- 75060
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
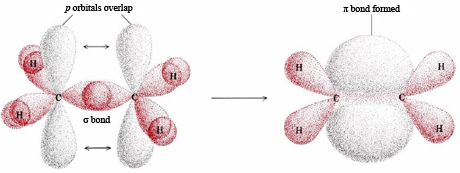
\(\newcommand{\avec}{\mathbf a}\) \(\newcommand{\bvec}{\mathbf b}\) \(\newcommand{\cvec}{\mathbf c}\) \(\newcommand{\dvec}{\mathbf d}\) \(\newcommand{\dtil}{\widetilde{\mathbf d}}\) \(\newcommand{\evec}{\mathbf e}\) \(\newcommand{\fvec}{\mathbf f}\) \(\newcommand{\nvec}{\mathbf n}\) \(\newcommand{\pvec}{\mathbf p}\) \(\newcommand{\qvec}{\mathbf q}\) \(\newcommand{\svec}{\mathbf s}\) \(\newcommand{\tvec}{\mathbf t}\) \(\newcommand{\uvec}{\mathbf u}\) \(\newcommand{\vvec}{\mathbf v}\) \(\newcommand{\wvec}{\mathbf w}\) \(\newcommand{\xvec}{\mathbf x}\) \(\newcommand{\yvec}{\mathbf y}\) \(\newcommand{\zvec}{\mathbf z}\) \(\newcommand{\rvec}{\mathbf r}\) \(\newcommand{\mvec}{\mathbf m}\) \(\newcommand{\zerovec}{\mathbf 0}\) \(\newcommand{\onevec}{\mathbf 1}\) \(\newcommand{\real}{\mathbb R}\) \(\newcommand{\twovec}[2]{\left[\begin{array}{r}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\ctwovec}[2]{\left[\begin{array}{c}#1 \\ #2 \end{array}\right]}\) \(\newcommand{\threevec}[3]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\cthreevec}[3]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \end{array}\right]}\) \(\newcommand{\fourvec}[4]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\cfourvec}[4]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \end{array}\right]}\) \(\newcommand{\fivevec}[5]{\left[\begin{array}{r}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\cfivevec}[5]{\left[\begin{array}{c}#1 \\ #2 \\ #3 \\ #4 \\ #5 \\ \end{array}\right]}\) \(\newcommand{\mattwo}[4]{\left[\begin{array}{rr}#1 \amp #2 \\ #3 \amp #4 \\ \end{array}\right]}\) \(\newcommand{\laspan}[1]{\text{Span}\{#1\}}\) \(\newcommand{\bcal}{\cal B}\) \(\newcommand{\ccal}{\cal C}\) \(\newcommand{\scal}{\cal S}\) \(\newcommand{\wcal}{\cal W}\) \(\newcommand{\ecal}{\cal E}\) \(\newcommand{\coords}[2]{\left\{#1\right\}_{#2}}\) \(\newcommand{\gray}[1]{\color{gray}{#1}}\) \(\newcommand{\lgray}[1]{\color{lightgray}{#1}}\) \(\newcommand{\rank}{\operatorname{rank}}\) \(\newcommand{\row}{\text{Row}}\) \(\newcommand{\col}{\text{Col}}\) \(\renewcommand{\row}{\text{Row}}\) \(\newcommand{\nul}{\text{Nul}}\) \(\newcommand{\var}{\text{Var}}\) \(\newcommand{\corr}{\text{corr}}\) \(\newcommand{\len}[1]{\left|#1\right|}\) \(\newcommand{\bbar}{\overline{\bvec}}\) \(\newcommand{\bhat}{\widehat{\bvec}}\) \(\newcommand{\bperp}{\bvec^\perp}\) \(\newcommand{\xhat}{\widehat{\xvec}}\) \(\newcommand{\vhat}{\widehat{\vvec}}\) \(\newcommand{\uhat}{\widehat{\uvec}}\) \(\newcommand{\what}{\widehat{\wvec}}\) \(\newcommand{\Sighat}{\widehat{\Sigma}}\) \(\newcommand{\lt}{<}\) \(\newcommand{\gt}{>}\) \(\newcommand{\amp}{&}\) \(\definecolor{fillinmathshade}{gray}{0.9}\)Una descripción del doble enlace es el modelo sigma-pi mostrado en la Figura 1. En este caso solo dos de los orbitales p en cada átomo de C están involucrados en la formación de híbridos. Consecuentemente se forman híbridos sp 2, separados por un ángulo de 120°. Dos de estos híbridos de cada átomo de C se superponen con orbitales H 1 s, mientras que el tercero se solapa con un híbrido sp 2 en el otro átomo de C. Esta superposición directamente entre los dos átomos de C se llama enlace sigma, y se abrevia por la letra griega σ. Este orbital no tiene nodos: la densidad de electrones existe continuamente de alrededor de un átomo al otro átomo.
Para ver el orbital de unión sigma, seleccione N6. Esto es en realidad unión sigma entre C-C y algunos enlaces sigma-como alrededor de la Hs también. Enfócate en la porción amarilla. Al seleccionar N8 HOMO, se puede ver el orbital pi representado por los dos lóbulos.
Los orbitales híbridos sp2 en cada átomo de carbono involucran los orbitales 2 s y dos de los 2 p, dejando un solo orbital de 2 p en cada átomo de carbono. Un segundo enlace carbono-carbono se forma por el solapamiento de estos dos orbitales p restantes. Esto se llama un enlace pi, letra griega π. El enlace pi (enlace π) tiene dos mitades, una por encima del plano de la molécula y la otra debajo de ella. Cada uno de los dos electrones en el enlace pi (enlace π) existe tanto por encima como por debajo del plano de los cuatro átomos de H y los dos átomos de C. El enlace pi se puede considerar como una onda estacionaria con un solo nodo en el plano de la molécula.
Si su estación de trabajo está habilitada para el software JCE, verá dos videos a continuación que comparan el comportamiento de una onda estacionaria con nodos cero frente a una onda estacionaria con un nodo (de lo contrario, vea la animación de batería a continuación). La onda con un solo nodo tiene mayor energía. El enlace sigma entre los dos átomos de carbono no tiene un nodo en el plano de la molécula. El enlace pi entre los dos átomos de carbono tiene un nodo en el plano de la molécula. Así, el orbital molecular pi es mayor en energía y es el orbital molecular ocupado más alto (el HOMO).
(a) Sin nodos (b) Nodo único
Demostradora de Ondas Permanentes en Ola. (a) La forma de energía más baja de una onda estacionaria no tiene nodos. Esto es como la densidad continua de electrones en todas las direcciones alrededor del orbital de unión sigma. (b) La segunda onda estacionaria de menor energía tiene un solo nodo. Este nodo es similar a la forma del enlace pi donde no hay densidad de electrones a lo largo del plano.
Alternativamente, podemos imaginar los orbitales moleculares con el Modelo de Tambor descrito anteriormente. Imagínese los dos átomos opuestos uno al otro donde una diagonal se encuentra con el borde del tambor en los puntos extremos izquierdo y derecho. El modo m 1,0 no tiene nodos, por lo que la amplitud máxima de la onda estacionaria se encuentra entre los átomos, lo que representa un enlace sigma de alta densidad de electrones. El modo m 2,1 tiene un nodo lineal entre los átomos, y amplitud máxima delante y detrás del nodo, que representa el enlace pi. En 3D, este nodo lineal sería un plano, separando los dos lóbulos de alta densidad de electrones que constituyen el enlace pi. Debido a que el enlace pi tiene menos densidad de electrones entre los átomos, es de mayor energía en el diagrama MO y es más débil que el enlace sigma.
En general, esta imagen sigma-pi del doble enlace recuerda a un hot dog en un moño. El enlace sigma (enlace σ) corresponde al frankfurter, mientras que el enlace pi corresponde al bollo a cada lado del mismo.
Aunque el cuadro sigma-pi es más complejo que el cuadro de enlace doblado del doble enlace, es muy utilizado por los químicos orgánicos (aquellos químicos interesados en los compuestos de carbono). El modelo sigma-pi es especialmente útil para entender lo que sucede cuando la luz visible u otra radiación es absorbida por una molécula. Más discusión sobre este tema se encuentra en las secciones de Espectros y Estructura de Átomos y Moléculas.

De hecho, la diferencia entre los dos modelos del doble enlace (el primer modelo descrito aquí y el segundo que se encuentra en la sección de Descripciones orbitales de enlaces múltiples) es más aparente que real. Están relacionados entre sí de la misma manera que los orbitales s y p están relacionados con híbridos sp. La Figura 2 muestra dos diagramas de densidad de puntos para un doble enlace carbono-carbono en un plano a través de ambos núcleos de carbono pero en ángulo recto con el plano de la molécula. La Figura 2 a corresponde a un modelo sigma-pi con el enlace sigma (enlace σ) en color y el enlace pi en gris. La Figura 2b muestra dos uniones dobladas. Una inspección cuidadosa revela que ambos diagramas son iguales punto por punto. Solo la codificación de color de los puntos es diferente. Así, los modelos de enlace doblado y sigma-pi del doble enlace son solo dos formas diferentes de dividir la misma densidad electrónica general.
Una situación similar se aplica a los enlaces triples, como el que se encuentra en una molécula de etino (acetileno), . Como se muestra en la Figura 3a, podemos considerar este triple enlace como resultado de tres superposiciones de híbridos sp 3 en diferentes átomos de carbono formando tres enlaces doblados. Alternativamente podemos considerarlo como compuesto por un enlace sigma y dos enlaces pi, siendo el enlace sigma debido a la superposición de un híbrido sp de cada átomo de carbono. Nuevamente ambas imágenes del enlace corresponden a la misma densidad electrónica global, y de ahí que ambas estén describiendo la misma realidad física. Podemos usar lo que parezca más conveniente para el problema que se está considerando.
. Como se muestra en la Figura 3a, podemos considerar este triple enlace como resultado de tres superposiciones de híbridos sp 3 en diferentes átomos de carbono formando tres enlaces doblados. Alternativamente podemos considerarlo como compuesto por un enlace sigma y dos enlaces pi, siendo el enlace sigma debido a la superposición de un híbrido sp de cada átomo de carbono. Nuevamente ambas imágenes del enlace corresponden a la misma densidad electrónica global, y de ahí que ambas estén describiendo la misma realidad física. Podemos usar lo que parezca más conveniente para el problema que se está considerando.

 . (a) Tres híbridos sp 3 de cada átomo de carbono se superponen para formar tres enlaces doblados. (b) Dos híbridos sp se superponen para formar el enlace sigma. Dos orbitales p en un carbono se superponen con dos en el otro para formar dos enlaces pi (uno en gris claro y el otro en gris oscuro). Aunque estos dos modelos parecen ser diferentes, la indistinguibilidad de los electrones los hace exactamente equivalentes.
. (a) Tres híbridos sp 3 de cada átomo de carbono se superponen para formar tres enlaces doblados. (b) Dos híbridos sp se superponen para formar el enlace sigma. Dos orbitales p en un carbono se superponen con dos en el otro para formar dos enlaces pi (uno en gris claro y el otro en gris oscuro). Aunque estos dos modelos parecen ser diferentes, la indistinguibilidad de los electrones los hace exactamente equivalentes.Los orbitales se pueden ver seleccionando del menú orbital a la derecha. Nuevamente, estos orbitales se representan más fácilmente usando un MO Cutoff de 0.005. Al seleccionar Al seleccionar N1 se puede ver el orbital de unión sigma. Los dos orbitales de unión pi se pueden ver seleccionando N6 y N7. Si gira la molécula para que veamos la molécula a lo largo de la línea H-C-C-H, puede cambiar de un lado a otro entre N6 y N7 para ver la orientación en el espacio.


