4.5: Espectroscopia de fotoluminiscencia, fosforescencia y fluorescencia
- Page ID
- 71051
La espectroscopia de fotoluminiscencia es un método sin contacto y no destructivo para sondear la estructura electrónica de los materiales. La luz se dirige sobre una muestra, donde es absorbida e imparte exceso de energía al material en un proceso llamado fotoexcitación. Una forma en que este exceso de energía puede ser disipado por la muestra es a través de la emisión de luz, o luminiscencia. En el caso de la fotoexcitación, esta luminiscencia se denomina fotoluminiscencia.
La fotoexcitación hace que los electrones dentro de un material pasen a estados excitados permisibles. Cuando estos electrones regresan a sus estados de equilibrio, el exceso de energía se libera y puede incluir la emisión de luz (un proceso radiativo) o puede no (un proceso no radiativo). La energía de la luz emitida (fotoluminiscencia) se relaciona con la diferencia en los niveles de energía entre los dos estados electrónicos involucrados en la transición entre el estado excitado y el estado de equilibrio. La cantidad de luz emitida está relacionada con la contribución relativa del proceso radiativo.
En la mayoría de los sistemas fotoluminiscentes, la agregación cromóforo generalmente apaga la emisión de luz a través de la extinción causada por la agregación (ACQ). Esto significa que es necesario utilizar y estudiar fluoróforos en soluciones diluidas o como moléculas aisladas. Esto a su vez da como resultado una mala sensibilidad de los dispositivos que emplean fluorescencia, por ejemplo, biosensores y bioensayos. Sin embargo, recientemente se han reportado ejemplos en los que la agregación de luminógenos jugó un papel constructivo, en lugar de destructivo en el proceso de emisión de luz. Esta emisión inducida por agregación (AIE) es de gran importancia potencial en particular con respecto a los dispositivos de estado sólido. La espectroscopia de fotoluminiscencia proporciona un buen método para el estudio de las propiedades luminiscentes de un fluoróforo.
Formas de fotoluminiscencia
- Radiación Resonante: En la radiación resonante, se absorbe un fotón de una longitud de onda particular y se emite inmediatamente un fotón equivalente, a través del cual no se involucran transiciones de energía internas significativas del sustrato químico entre absorción y emisión y el proceso suele ser de un orden de 10 nanosegundos.
- Fluorescencia: Cuando el sustrato químico experimenta transiciones internas de energía antes de relajarse a su estado fundamental emitiendo fotones, parte de la energía absorbida se disipa de manera que los fotones de luz emitidos son de menor energía que los absorbidos. Uno de esos fenómenos más familiares es la fluorescencia, que tiene una vida útil corta (10 -8 a 10 -4 s).
- Fosforescencia: La fosforescencia es una transición radiacional, en la que la energía absorbida se somete a cruce intersistémico a un estado con una multiplicidad de espín diferente. La vida útil de la fosforescencia suele ser de 10 -4 - 10 -2 s, mucho más larga que la de Fluorescencia. Por lo tanto, la fosforescencia es incluso más rara que la fluorescencia, ya que una molécula en estado triplete tiene una buena probabilidad de someterse a un cruce intersistémico al estado fundamental antes de que pueda ocurrir la fosforescencia.
Relación entre los espectros de absorción y emisión
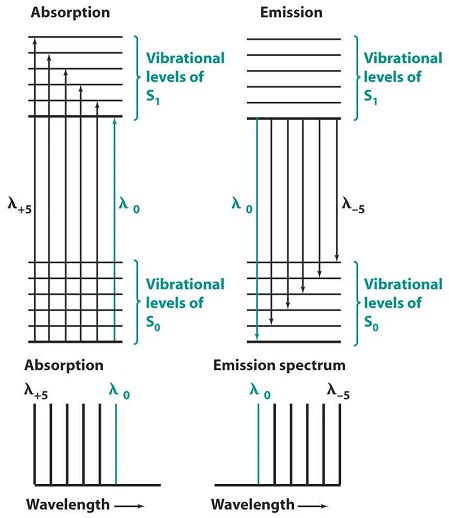
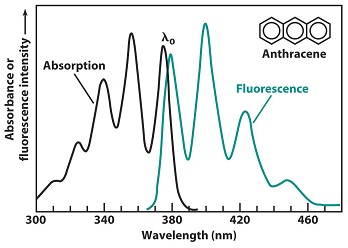
La fluorescencia y la fosforescencia vienen a menor energía que la absorción (la energía de excitación). Como se muestra en la Figura\(\PageIndex{1}\), en absorción, la longitud de onda λ 0 corresponde a una transición desde el nivel vibratorio del suelo de S0 al nivel vibratorio más bajo de S1. Después de la absorción, la molécula S1 excitada vibracionalmente se relaja de nuevo al nivel vibracional más bajo de S1 antes de emitir cualquier radiación. La transición de energía más alta viene a la longitud de onda λ 0, con una serie de picos siguiendo a una longitud de onda más larga Los espectros de absorción y emisión tendrán una relación aproximada de imagen especular si las distancias entre los niveles de vibración son aproximadamente iguales y si las probabilidades de transición son similares. Las transiciones λ 0 en la Figura\(\PageIndex{2}\), no se superponen exactamente. Como se muestra en la Figura\(\PageIndex{8}\), una molécula que absorbe radiación se encuentra inicialmente en su estado básico electrónico, S 0. Esta molécula posee cierta geometría y solvatación. Como la transición electrónica es más rápida que el movimiento vibratorio de los átomos o el movimiento traslacional de las moléculas solventes, cuando la radiación es absorbida por primera vez, la molécula S1 excitada aún posee su geometría S 0 y solvatación. Poco después de la excitación, la geometría y la solvatación cambian a sus valores más favorables para el estado S1. Este reordenamiento disminuye la energía de la molécula excitada. Cuando una molécula S1 fluoresce, vuelve al estado S 0 con geometría S1 y solvatación. Esta configuración inestable debe tener una energía mayor que la de una molécula S 0 con geometría S 0 y solvatación. El efecto neto en la Figura\(\PageIndex{1}\) es que la energía de emisión λ 0 es menor que la energía de excitación λ 0.
Instrumentación
Un esquema de un experimento de emision se da en la Figura\(\PageIndex{3}\). Una longitud de onda de excitación es seleccionada por un monocromador, y la luminiscencia se observa a través de un segundo monocromador, generalmente posicionado a 90° con respecto a la luz incidente para minimizar la intensidad de la luz dispersada que llega al dector. Si la longitud de onda de excitación es fija y se escanea la radiación emitida, se produce un espectro de emisión.

Relación con la espectroscopia UV-Vis
La espectroscopia ultravioleta-visible (UV-Vis) o espectrofotometría ultravioleta-visible se refiere a la espectroscopia de absorción o espectroscopia de reflectancia en la región espectral no travioleta-visible. La absorción o reflectancia en el rango visible afecta directamente el color percibido de los químicos involucrados. En el espectro UV-Vis, se obtiene un gráfico de absorbancia versus longitud de onda y mide las transiciones del estado fundamental al estado excitado, mientras que la fotoluminiscencia se ocupa de las transiciones del estado excitado al estado fundamental.
Un espectro de excitación es un gráfico de intensidad de emisión versus longitud de onda de excitación. Un espectro de excitación se parece mucho a un espectro de absorción. Cuanto mayor sea la absorbancia a la longitud de onda de excitación, más moléculas se promoverán al estado excitado y más emisión se observará.
Al ejecutar un espectro de absorción UV-Vis, se puede obtener la longitud de onda a la que la molécula absorbe más energía y se excita en gran medida. El uso de un valor tal como la longitud de onda de excitación puede proporcionar así una emisión más intensa a una longitud de onda desplazada al rojo, que generalmente está dentro del doble de la longitud de onda
Aplicaciones
Detección de propiedades ACQ o AIE
La extinción causada por la agregación (ACQ) de la emisión de luz es un fenómeno general para muchos compuestos aromáticos que la fluorescencia se debilita con un aumento en su concentración de solución e incluso la fase condensada. Dicho efecto, sin embargo, entra en juego en estado sólido, lo que ha impedido que muchos luminógenos de plomo identificados por el proceso de cribado de soluciones de laboratorio encuentren aplicaciones del mundo real en una forma robusta de ingeniería.
La emisión inducida por agregación (AIE), por otro lado, es un fenómeno novedoso que la agregación juega un papel constructivo, en lugar de destructivo en el proceso de emisión de luz, que es exactamente opuesto al efecto ACQ.
Un estudio de caso
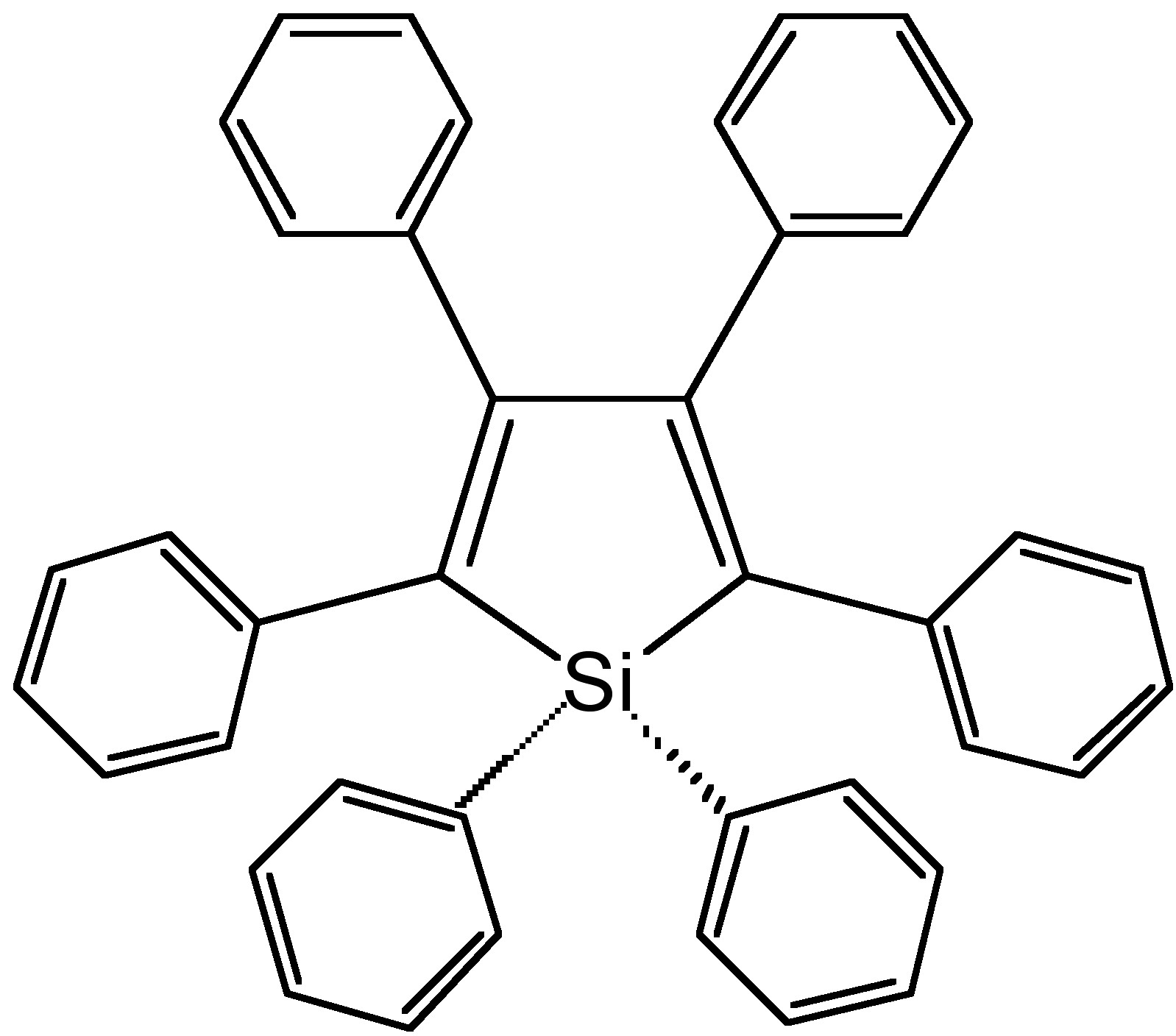
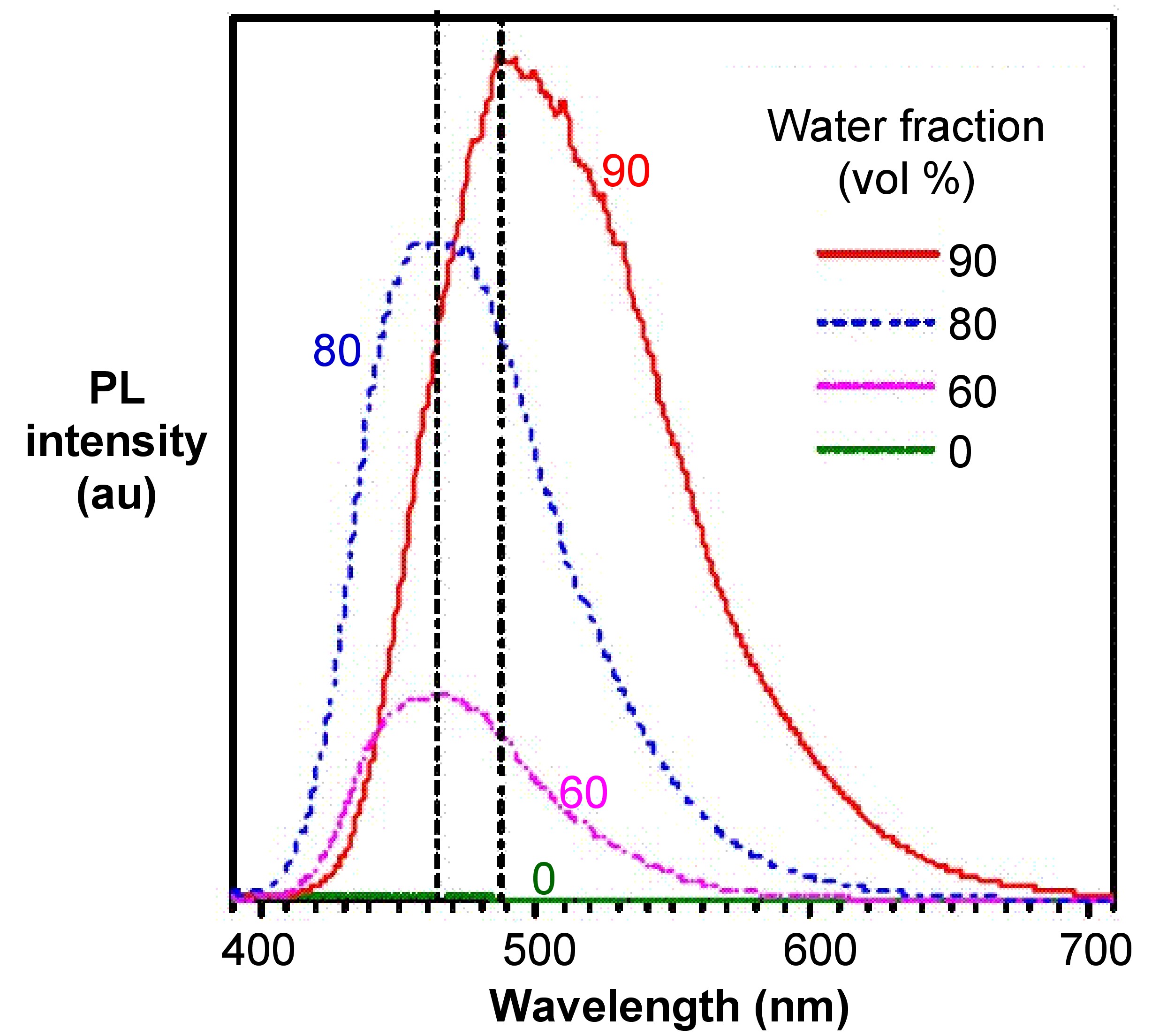
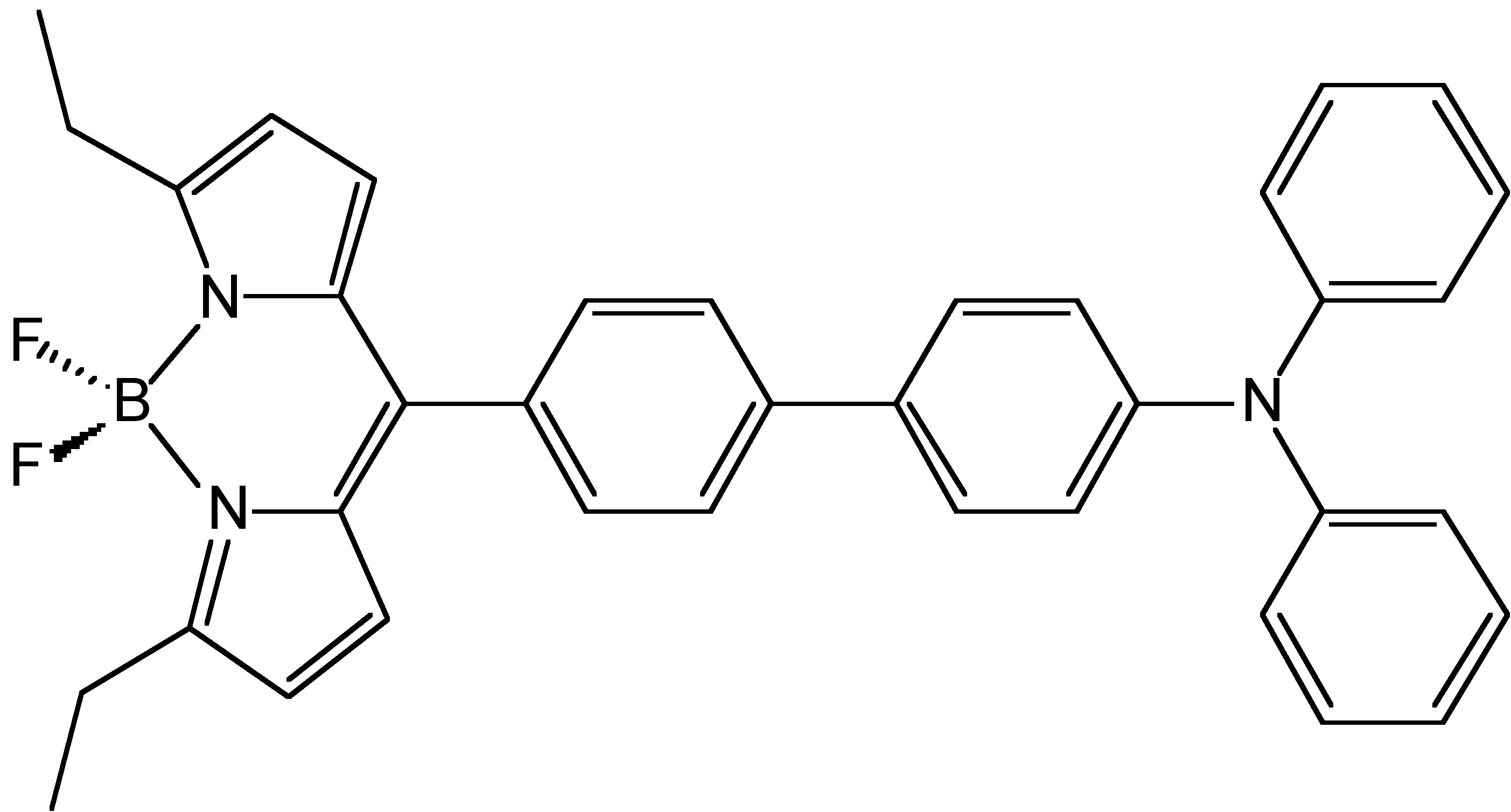
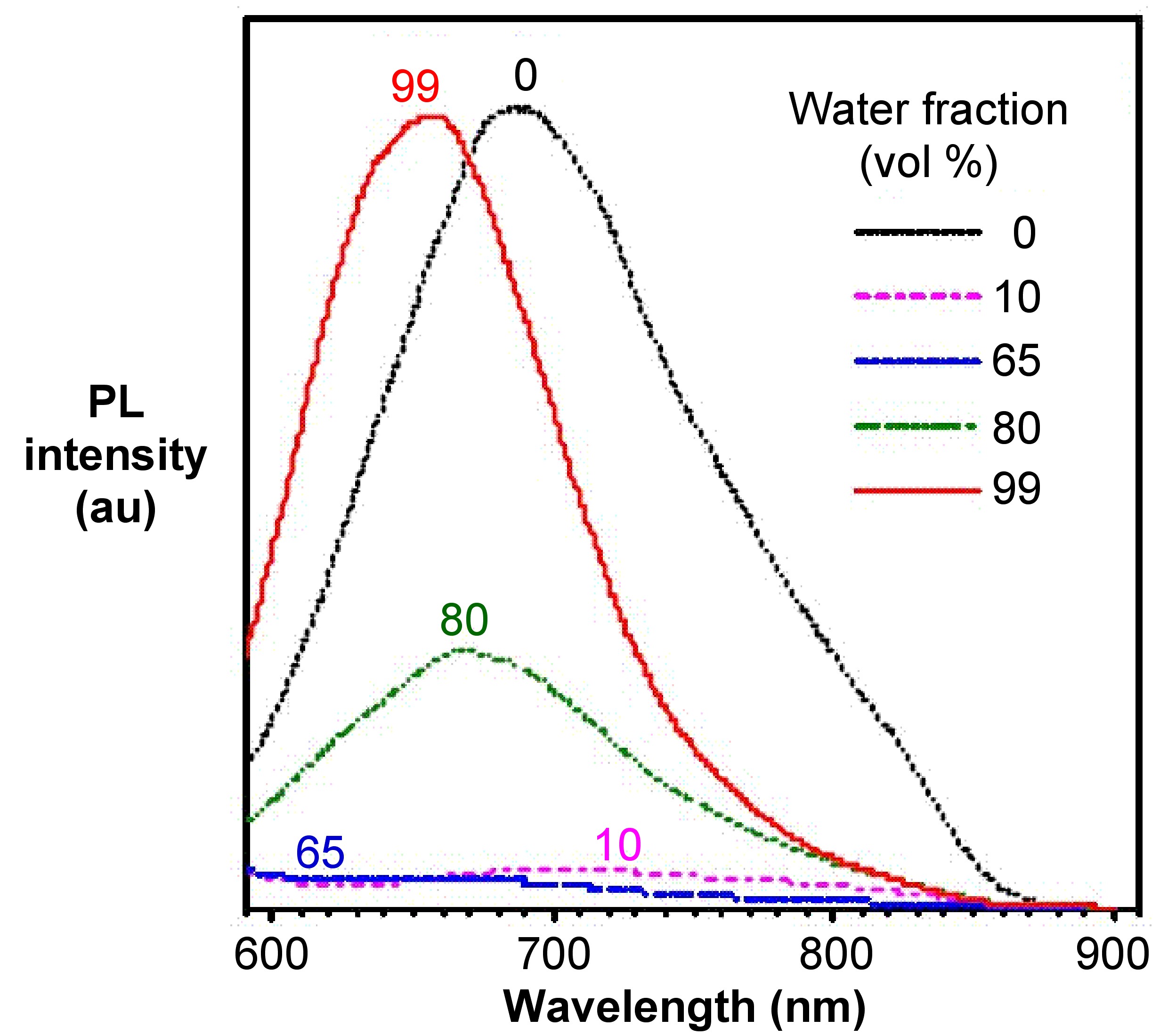
A partir de los espectros de fotoluminiscencia del hexafenilsilole (HPS, Figura\(\PageIndex{4}\)) mostrados en la Figura\(\PageIndex{5}\), se puede observar que a medida que aumenta la fracción de agua (mal disolvente), aumenta la intensidad de emisión de HPS. Para la Figura derivada de BODIPY\(\PageIndex{6}\) en la Figura\(\PageIndex{7}\), muestra que los picos de intensidad PL a 0 contenido de agua resultaron de rotación intramolecular o torsión, conocida como transferencia de carga intramolecular retorcida (TICT).
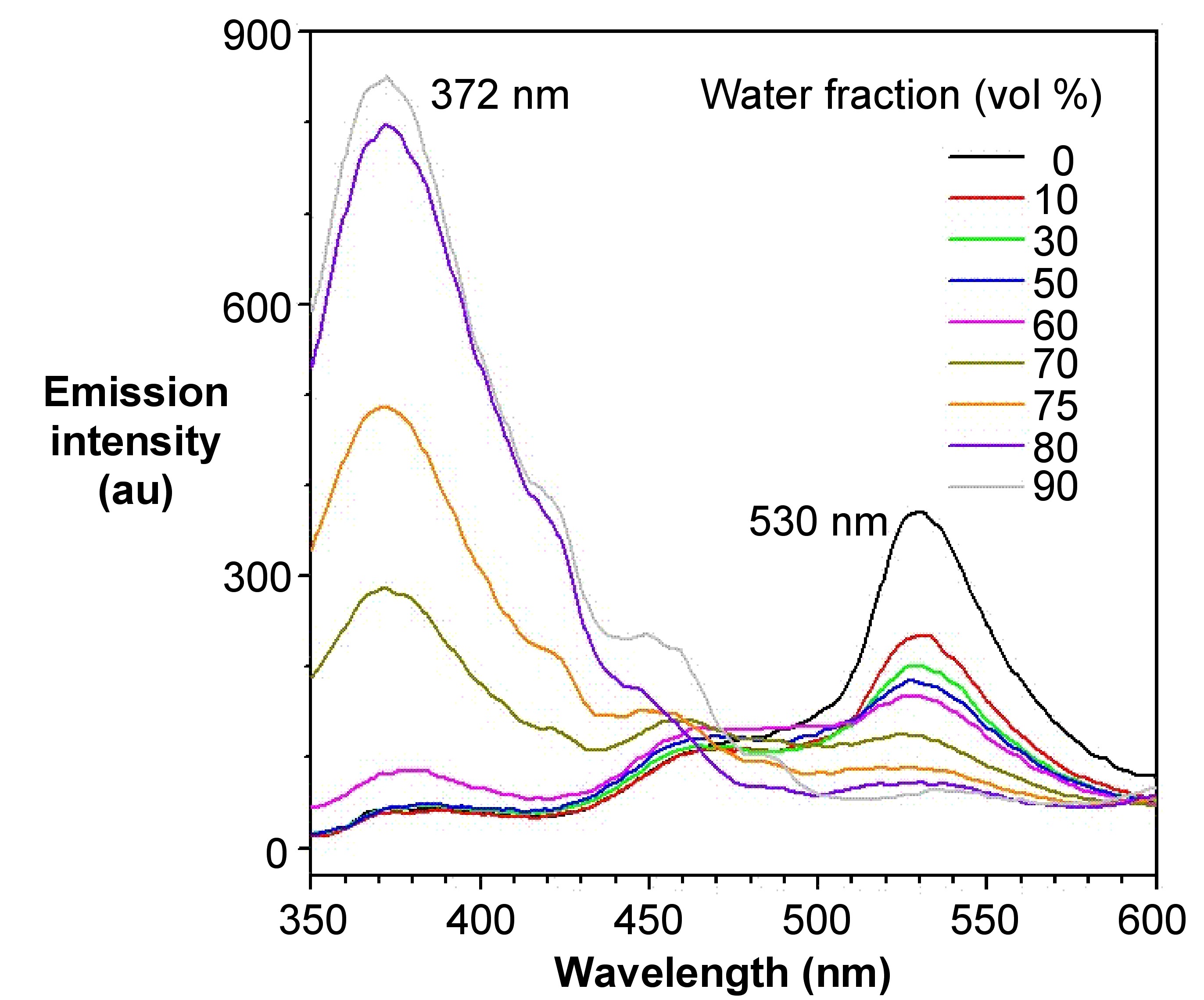
El color de emisión de un luminógeno AIE apenas se ve afectado por la polaridad del disolvente, mientras que el de un luminógeno TICT típicamente se desplaza batocrómicamente al aumentar la polaridad del disolvente. En la Figura\(\PageIndex{8}\), sin embargo, muestra diferentes patrones de emisión bajo diferentes longitudes de onda de excitación. A la longitud de onda de excitación de 372 nm, que corresponde al grupo BODIPY, la intensidad de emisión aumenta a medida que aumenta la fracción de agua. Sin embargo, disminuye a la longitud de onda de excitación de 530 nm, que corresponde al grupo TPE. La presencia de dos emisiones en este compuesto se debe a la presencia de dos grupos independientes en el compuesto con propiedades AIE y ACQ, respectivamente.
Detección de luminiscencia con respecto a la molaridad
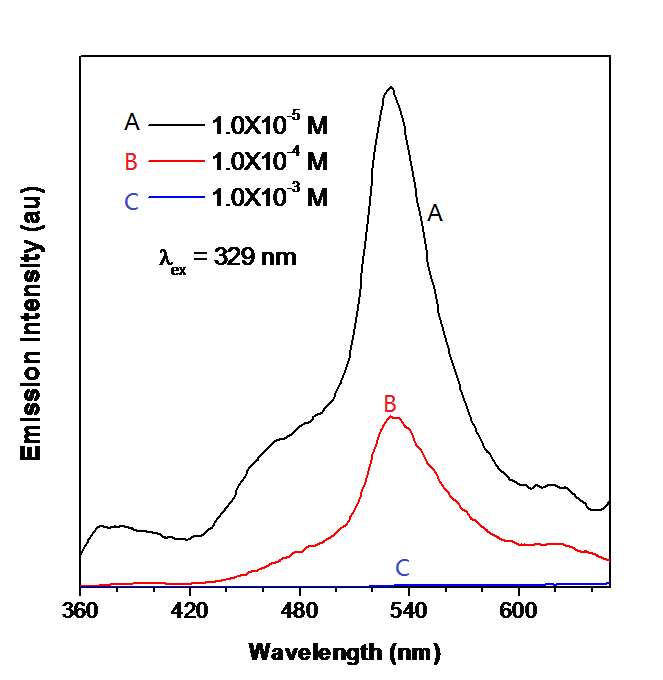
La figura\(\PageIndex{9}\) muestra la espectroscopía de fotoluminiscencia de un derivado de BODIPY-TPE de diferentes concentraciones. A la longitud de onda de excitación de 329 nm, a medida que aumenta la molaridad, la intensidad de emisión disminuye. Dichos compuestos cuya intensidad de emisión de PL potencia a baja concentración pueden ser un buen quimio-sensor para la detección de la presencia de compuestos con baja cantidad.
Otras aplicaciones
Además de la detección de patrones de emisión de luz, la espectroscopia de fotoluminiscencia es de gran importancia en otros campos de análisis, especialmente los semiconductores.
Determinación de la brecha de banda
La brecha de banda es la diferencia de energía entre los estados en las bandas de conducción y valencia, de la transición radiativa en semiconductores. La distribución espectral de PL a partir de un semiconductor se puede analizar para determinar de manera no destructiva la brecha de banda electrónica. Esto proporciona un medio para cuantificar la composición elemental del semiconductor compuesto y es un parámetro de material de vital importancia que influye en la eficiencia del dispositivo de células solares.
Niveles de impurezas y detección de defectos
Las transiciones radiativas en semiconductores implican niveles de defectos localizados. La energía de fotoluminiscencia asociada a estos niveles puede ser utilizada para identificar defectos específicos, y la cantidad de fotoluminiscencia puede ser utilizada para determinar su concentración. El espectro PL a bajas temperaturas de muestra a menudo revela picos espectrales asociados con impurezas contenidas dentro del material huésped. La microespectroscopía de fotoluminiscencia por transformada de Fourier, que es de alta sensibilidad, proporciona el potencial de identificar concentraciones extremadamente bajas de impurezas intencionales y no intencionales que pueden afectar fuertemente la calidad del material y el rendimiento del dispositivo.
Mecanismos de recombinación
El retorno al equilibrio, conocido como “recombinación”, puede implicar procesos tanto radiativos como no radiativos. La cantidad de PL emitida por un material está directamente relacionada con la cantidad relativa de tasas de recombinación radiativa y no radiativa. Las tasas no radiativas se asocian típicamente con impurezas y la cantidad de fotoluminiscencia y su dependencia del nivel de fotoexcitación y temperatura están directamente relacionadas con el proceso de recombinación dominante. Así, el análisis de fotoluminiscencia puede monitorear cualitativamente los cambios en la calidad del material en función de las condiciones de crecimiento y procesamiento y ayudar a comprender la física subyacente del mecanismo de recombinación.
Superficie y Estructura y Estados Emocionados
Los métodos convencionales ampliamente utilizados como la espectroscopia XRD, IR y Raman, a menudo no son lo suficientemente sensibles para catalizadores de óxido soportados con bajas concentraciones de óxido metálico. La fotoluminiscencia, sin embargo, es muy sensible a los efectos superficiales o especies adsorbidas de partículas semiconductoras y, por lo tanto, puede usarse como sonda de procesos de superficie de huecos de electrones.
Limitaciones de la espectroscopia de fotoluminiscencia
Se pueden detectar concentraciones muy bajas de centros ópticos mediante fotoluminiscencia, pero generalmente no es una técnica cuantitativa. La principal limitación científica de la fotoluminiscencia es que muchos centros ópticos pueden tener múltiples estados excitados, los cuales no están poblados a baja temperatura.
La desaparición de la señal de luminiscencia es otra limitación de la espectroscopia de fotoluminiscencia. Por ejemplo, en la caracterización de centros de fotoluminiscencia de silicio no se observó fotoluminiscencia de línea aguda de 969 centros MeV cuando se habían capturado autointersticiales.
Caracterización por fluorescencia y detección de ADN
La luminiscencia es un proceso que implica la emisión de luz de cualquier sustancia, y ocurre a partir de estados electrónicamente excitados de esa sustancia. Normalmente, la luminiscencia se divide en dos categorías, fluorescencia y fosforescencia, dependiendo de la naturaleza del estado excitado.
La fluorescencia es la emisión de luz de radiación electromagnética por una sustancia que ha absorbido radiación de una longitud de onda diferente. La fosforescencia es un tipo específico de fotoluminiscencia relacionada con la fluorescencia. A diferencia de la fluorescencia, un material fosforescente no vuelve a emitir inmediatamente la radiación que absorbe.
El proceso de absorción y emisión fluorescente se ilustra fácilmente mediante el diagrama de Jablonski. En la Figura se muestra un diagrama clásico de Jablonski\(\PageIndex{10}\), donde S n representa los n estados electrónicos. Hay diferentes estados vibracionales y rotacionales en cada estado electrónico. Después de la absorción de luz, un fluoróforo se excita a un estado electrónico y vibracional superior desde el estado fundamental (aquí los estados rotacionales no se consideran por simplicidad). Por conversión interna de energía, estas moléculas excitadas se relajan a estados vibracionales más bajos en S1 (Figura\(\PageIndex{10}\)) y luego regresan a los estados básicos emitiendo fluorescencia. En realidad, las moléculas excitadas siempre regresan a estados de vibración más altos en S 0 y seguidas de algún proceso térmico a estados de tierra en S1. También es posible que algunas moléculas se sometan a proceso de cruce intersistémico a estados T 2 (Figura\(\PageIndex{10}\)). Después de la conversión interna y la relajación a T 1, estas moléculas pueden emitir fosforescencia y regresar a los estados básicos.
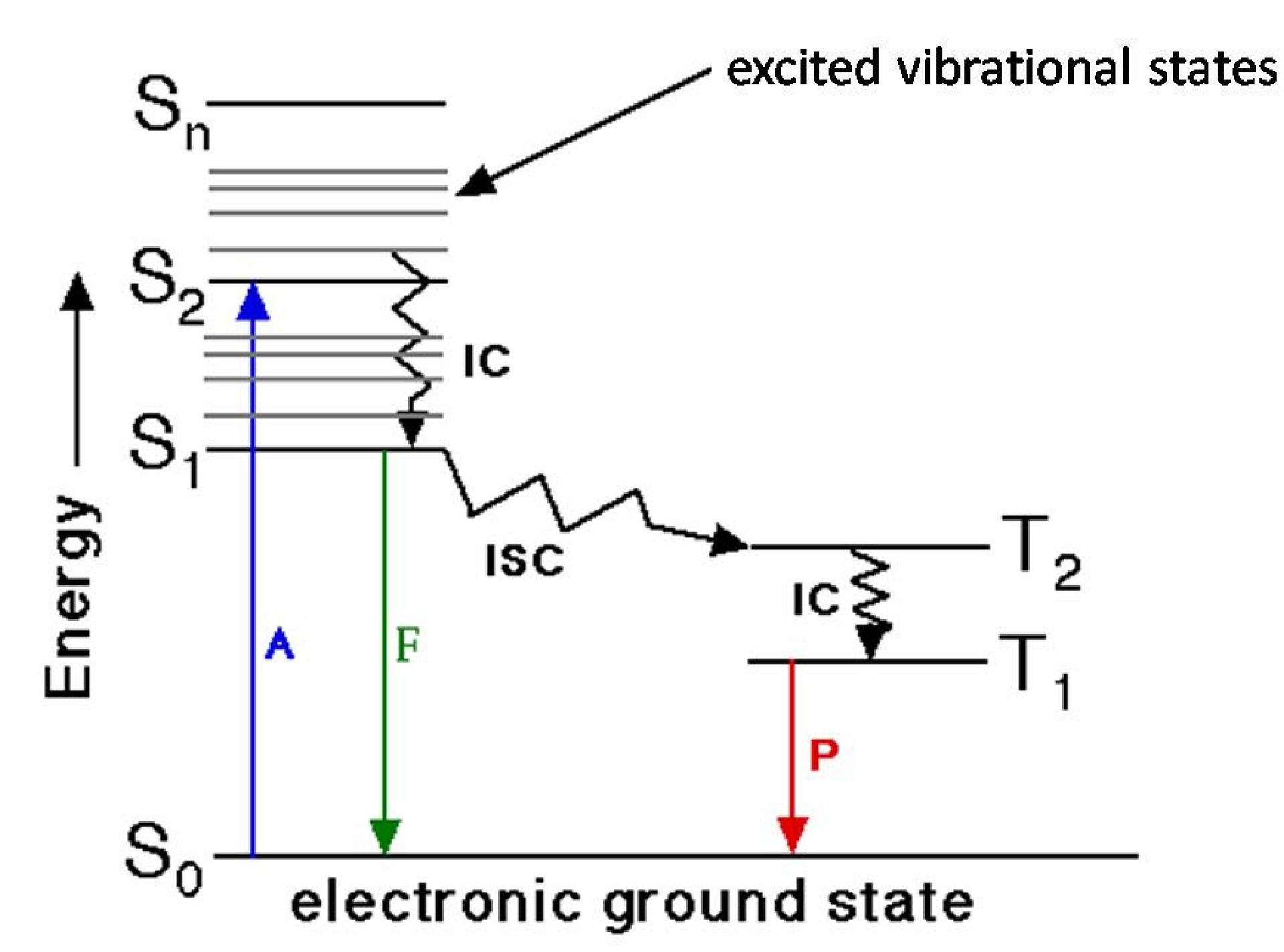
El cambio de Stokes, la vida útil del estado excitado y el rendimiento cuántico son las tres características más importantes de la emisión de fluorescencia. El desplazamiento de Stokes es la diferencia entre las posiciones de los máximos de banda de los espectros de absorción y emisión de la misma transición electrónica. De acuerdo con el mecanismo discutido anteriormente, un espectro de emisión debe tener menor energía o longitud de onda más larga que la luz de absorción. El rendimiento cuántico es una medida de la intensidad de fluorescencia, definida por la relación de fotones emitidos sobre fotones absorbidos. La vida útil del estado excitado es una medida de los tiempos de descomposición de la fluorescencia.
Instrumentación de Espectroscopia de Fluorescencia
Espectrofluorómetros
La mayoría de los espectrofluorómetros pueden registrar espectros de excitación y emisión. Un espectro de emisión es la distribución de longitud de onda de una emisión medida a una única longitud de onda de excitación constante. En comparación, se mide un espectro de excitación a una única longitud de onda de emisión explorando la longitud de onda de excitación.
Fuentes de Luz
Se eligen fuentes de luz específicas dependiendo de la aplicación.
Lámparas de arco y xenón incandescentes
El arco de xenón de alta presión (Xe) es ahora la fuente de luz más versátil para fluorómetros de estado estacionario. Puede proporcionar una salida de luz constante de 250 a 700 nm (Figura\(\PageIndex{11}\)), con solo algunas líneas nítidas cerca de 450 y 800 nm. La razón por la que las lámparas de arco de xenón emiten una luz continua es la recombinación de electrones con átomos de Xe ionizados. Estos iones se producen por colisión entre Xe y electrones. Esas líneas agudas cercanas a 450 nm se deben a los átomos Xe excitados que no están ionizados.
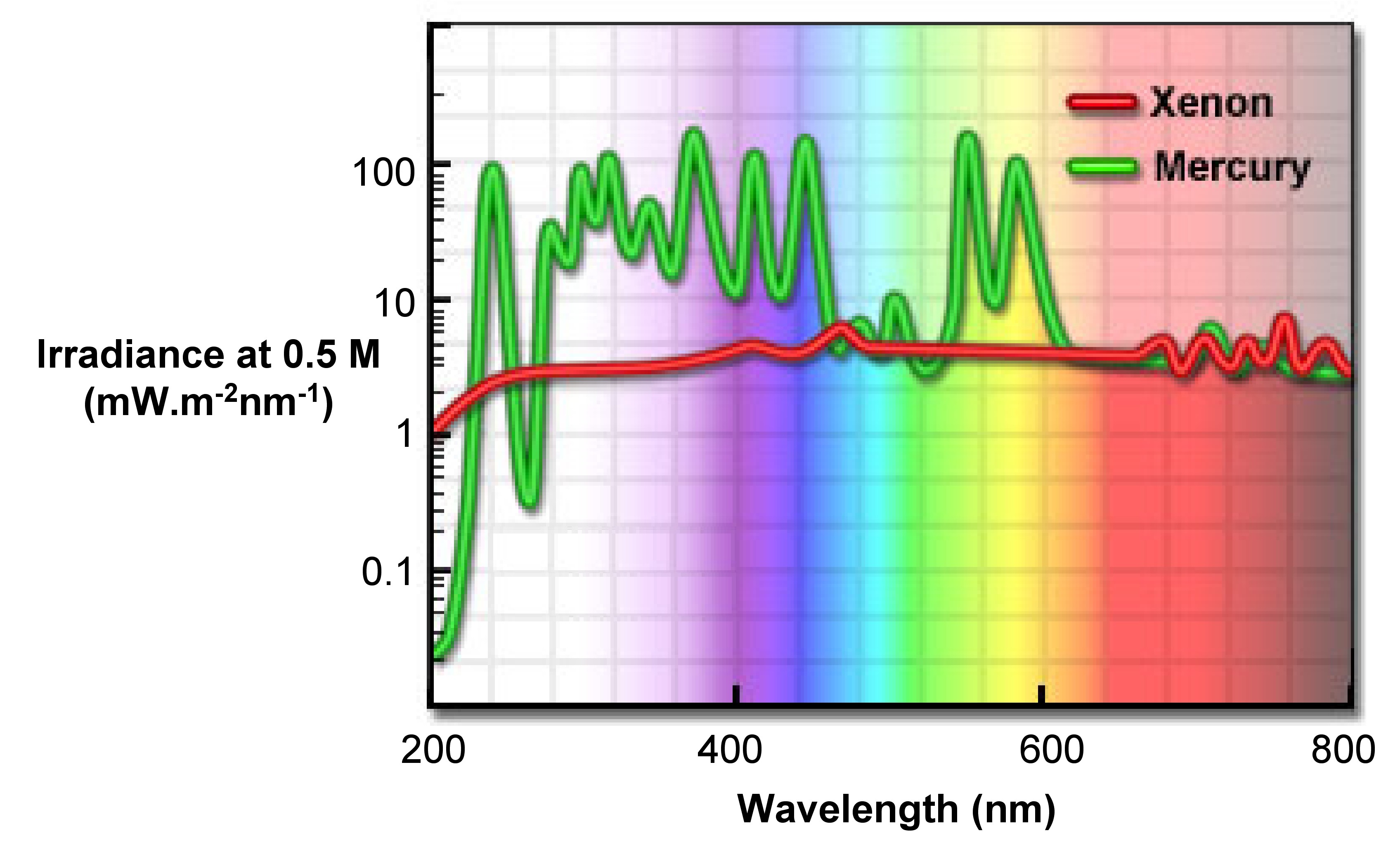
Durante el experimento de fluorescencia, se puede observar cierta distorsión de los espectros de excitación, especialmente la absorbancia que se localiza en la región visible y ultravioleta. Cualquier distorsión mostrada en los picos es el resultado de la salida dependiente de la longitud de onda de las lámparas Xe. Por lo tanto, necesitamos aplicar algunos enfoques matemáticos y físicos para la corrección.
Lámparas de mercurio de alta presión
En comparación con las lámparas de xenón, las lámparas de Hg tienen intensidades más altas. Como se muestra en\(\PageIndex{11}\) la Figura la intensidad de las lámparas de Hg se concentra en una serie de líneas, por lo que es una fuente de luz de excitación potencialmente mejor si se corresponde con cierta fluororescencia.
Lámparas de arco Xe-Hg
Se han producido lámparas de xenón-mercurio de alta presión. Tienen una intensidad mucho mayor en la región ultravioleta que las lámparas Xe normales. Además, la introducción de las lámparas Xe a Hg amplía la salida de línea nítida de las lámparas de Hg. Aunque la longitud de onda de salida aún está dominada por esas líneas de Hg, estas líneas se ensanchan y se ajustan mejor a diversos fluoróforos. La salida de la lámpara Xe-Hg depende de la temperatura de funcionamiento.
Lámparas de Hg y Hg-Ar de Baja Presión
Debido a sus espectros de línea muy nítidos, son principalmente útiles para fines de calibración. La combinación de Hg y Ar mejoran la escala de salida, de 200 a 1000 nm.
Otra fuente de luz
Hay muchas otras fuentes de luz para aplicaciones experimentales e industriales, como lámparas de xenón pulsado, lámparas halógenas de cuarzo-tungsteno (QTH), fuentes de luz LED, etc.
Monocromadores
La mayoría de las fuentes de luz utilizadas proporcionan solo luz policromática o blanca. Sin embargo, lo que se necesita para los experimentos son diversas luces cromáticas con un rango de longitud de onda de 10 nm. Los monocharomadores nos ayudan a lograr este objetivo. Los prismas y las rejillas de difracción son los dos tipos principales de monocromadores utilizados, aunque las rejillas de difracción son las más útiles, especialmente en espectrofluorómetros.
La dispersión, la eficiencia, el nivel de luz parásita y la resolución son parámetros importantes para los monocromadores. La dispersión se determina principalmente por el ancho de la hendidura y se expresa en nm/mm. Está preparado para tener bajo nivel de luz parásita. La luz parásita se define como la luz transmitida por el monocromador a una longitud de onda fuera del rango elegido. Además, se requiere una alta eficiencia para aumentar la capacidad de detectar niveles bajos de luz. La resolución depende del ancho de la hendidura. Normalmente hay dos hendiduras, entrada y salida en un fluorómetro. La intensidad de la luz que pasa a través de las ranuras es proporcional al cuadrado de la anchura de la hendidura. Las rendijas más grandes tienen niveles de señal más grandes, pero una resolución más baja, y viceversa. Por lo tanto, es importante equilibrar la intensidad y resolución de la señal con el ancho de la hendidura.
Filtros ópticos
Los filtros ópticos se utilizan además de los monocromadores, debido a que la luz que pasa a través del monocromador rara vez es ideal, se necesitan filtros ópticos para purificar aún más la fuente de luz. Si se estudian las propiedades básicas de excitación y emisión de un sistema en particular, entonces la selectividad mediante el uso de filtros ópticos es mejor que por el uso de monocromadores. Poco a poco se emplean dos tipos de filtros ópticos: filtros coloreados y filtros de película delgada.
Filtros de colores
Los filtros coloreados son los filtros más tradicionales utilizados antes de que se desarrollaran los filtros de película delgada. Se pueden dividir en dos categorías: filtro monocromático y filtro de paso largo. El primero solo pasa un pequeño rango de luz (aproximadamente 10 - 25 nm) centrado a una longitud de onda determinada. En contraste, el filtro de paso largo transmite todas las longitudes de onda por encima de una longitud de onda particular. Al usar estos filtros pasabanda, se debe prestar especial atención a la posibilidad de emisión desde el propio filtro, ya que muchos filtros están compuestos por materiales luminiscentes que son fácilmente excitados por la luz UV. Para evitar este problema, es mejor configurar el filtro más lejos de la muestra.
Filtros de película delgada
Las curvas de transmisión del filtro de clase coloreado no son adecuadas para alguna aplicación y como tales están siendo sustituidas gradualmente por filtros de película delgada. Casi cualquier curva de transmisión deseada se puede obtener usando un filtro de película delgada.
Detectores
El detector estándar utilizado en muchos espectrofluorómetros es la matriz InGaAs, que puede proporcionar una caracterización espectral rápida y robusta en el IR cercano. Y el enfriamiento líquido-nitrógeno se aplica para disminuir el ruido de fondo. Normalmente, los detectores están conectados a un controlador que puede transferir una señal digital hacia y desde la computadora.
Fluoróforos
En la actualidad se ha desarrollado una amplia gama de fluoróforos como sondas de fluorescencia en biosystem. Son ampliamente utilizados para el diagnóstico clínico, bio-tracking y etiquetado. El avance de los fluorómetros ha ido acompañado de desarrollos en química de fluoróforos. Se han sintetizado miles de fluoróforos, pero en este documento se discutirán cuatro categorías de fluoróforos con respecto a sus propiedades espectrales y aplicación.
Fluoróforos intrínsecos o naturales
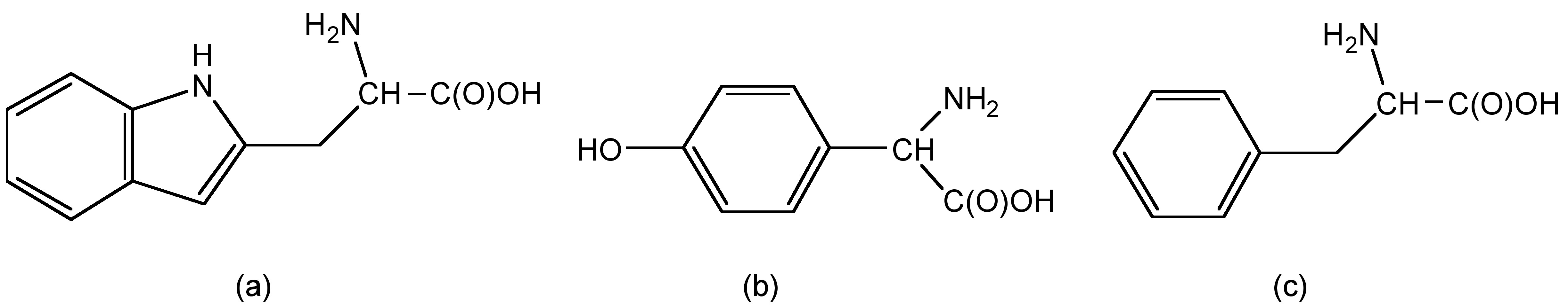
El triptófano (trp), la tirosina (tyr) y la fenilalanina (phe) son tres aminoácidos naturales con fuerte fluorescencia (Figura\(\PageIndex{12}\)). En triptófano, los grupos indol absorben la luz de excitación como región UV y emiten fluorescencia.
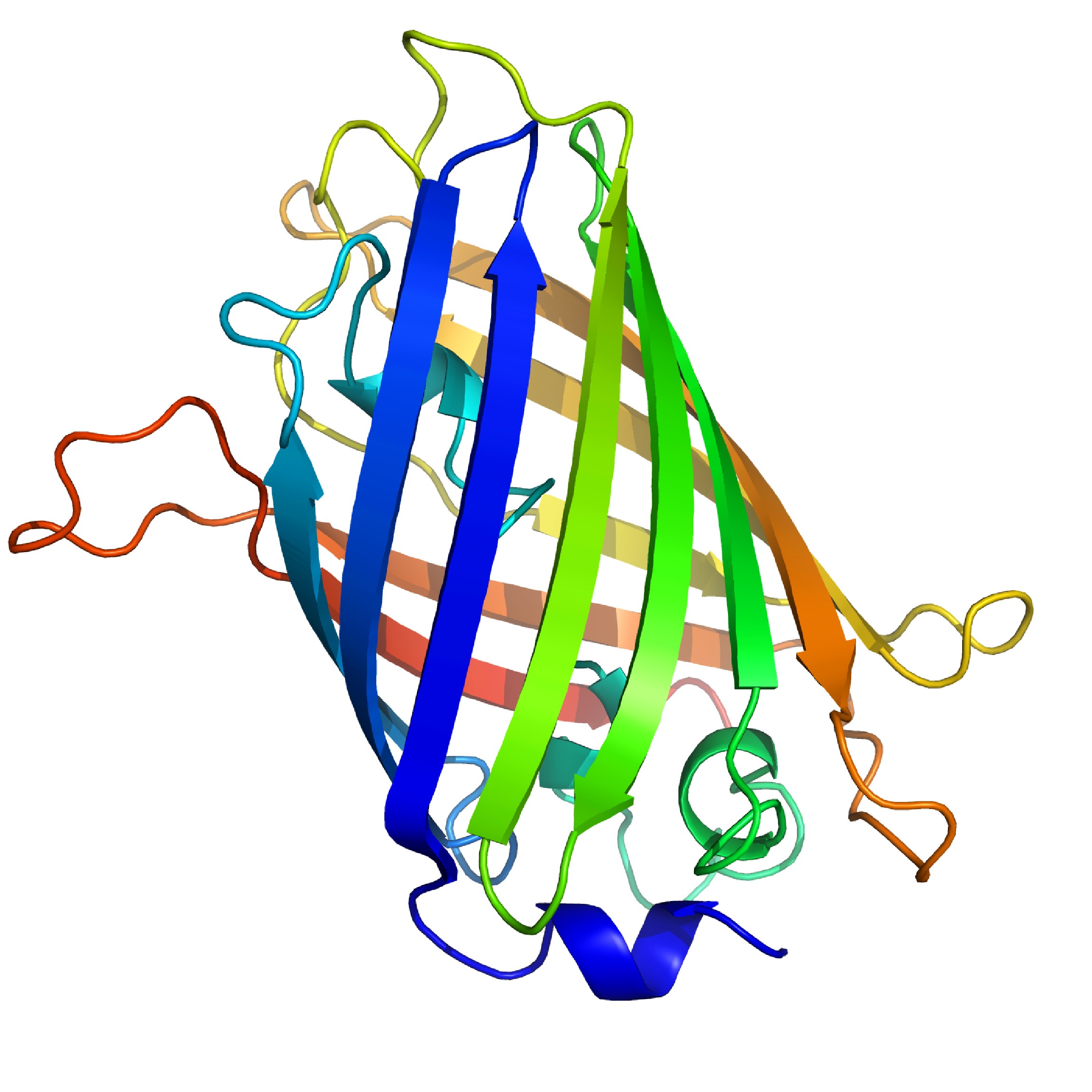
Las proteínas fluorescentes verdes (GFP) son otros fluoróforos naturales. GFP está compuesta por 238 aminoácidos (Figura\(\PageIndex{13}\)), y exhibe una fluorescencia verde brillante característica cuando se excita. Se extraen principalmente de medusas bioluminiscentes Aequorea vicroria, y se emplean como indicadores de señal en biología molecular.
Fluoróforos extrínsecos
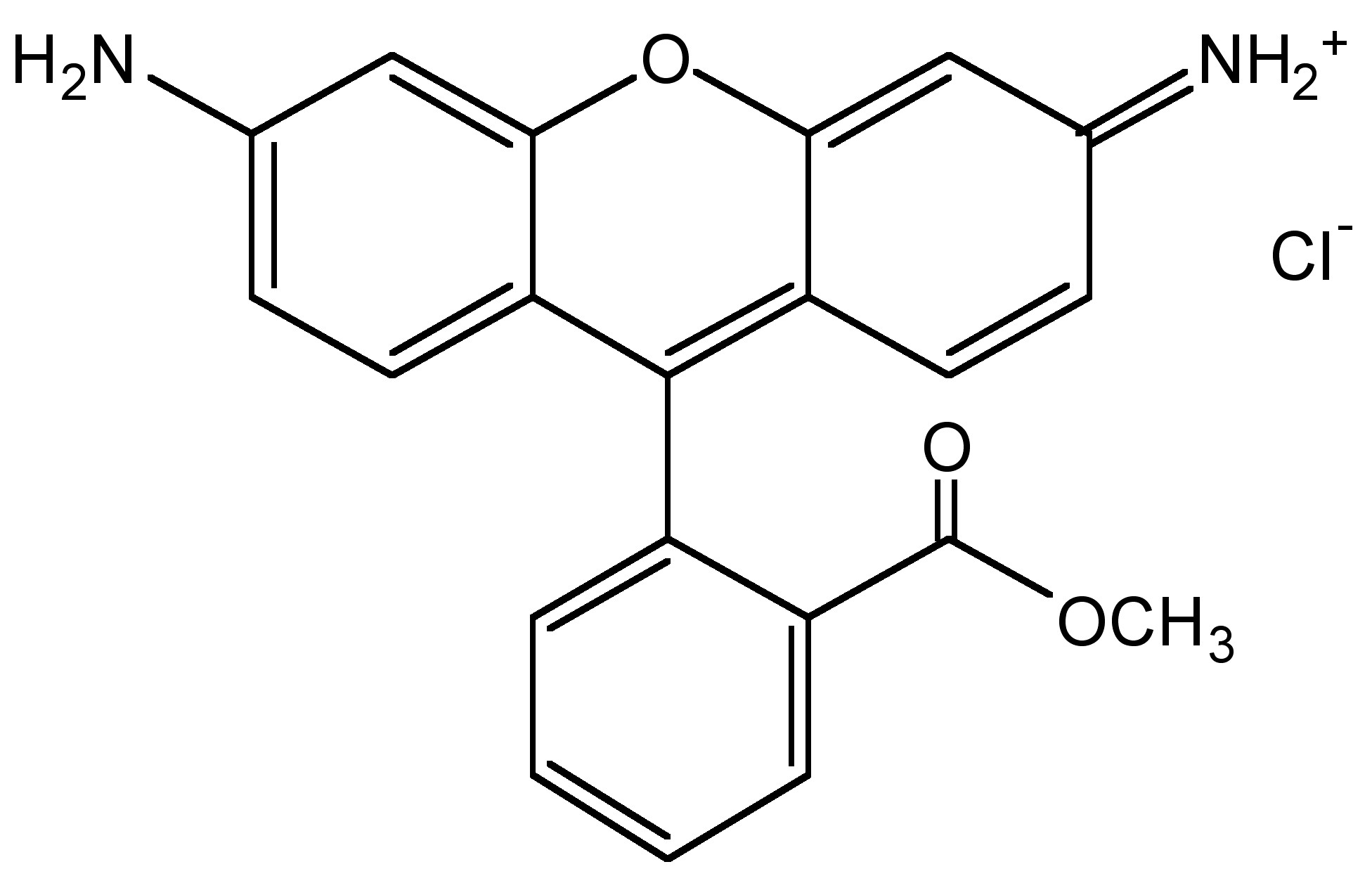
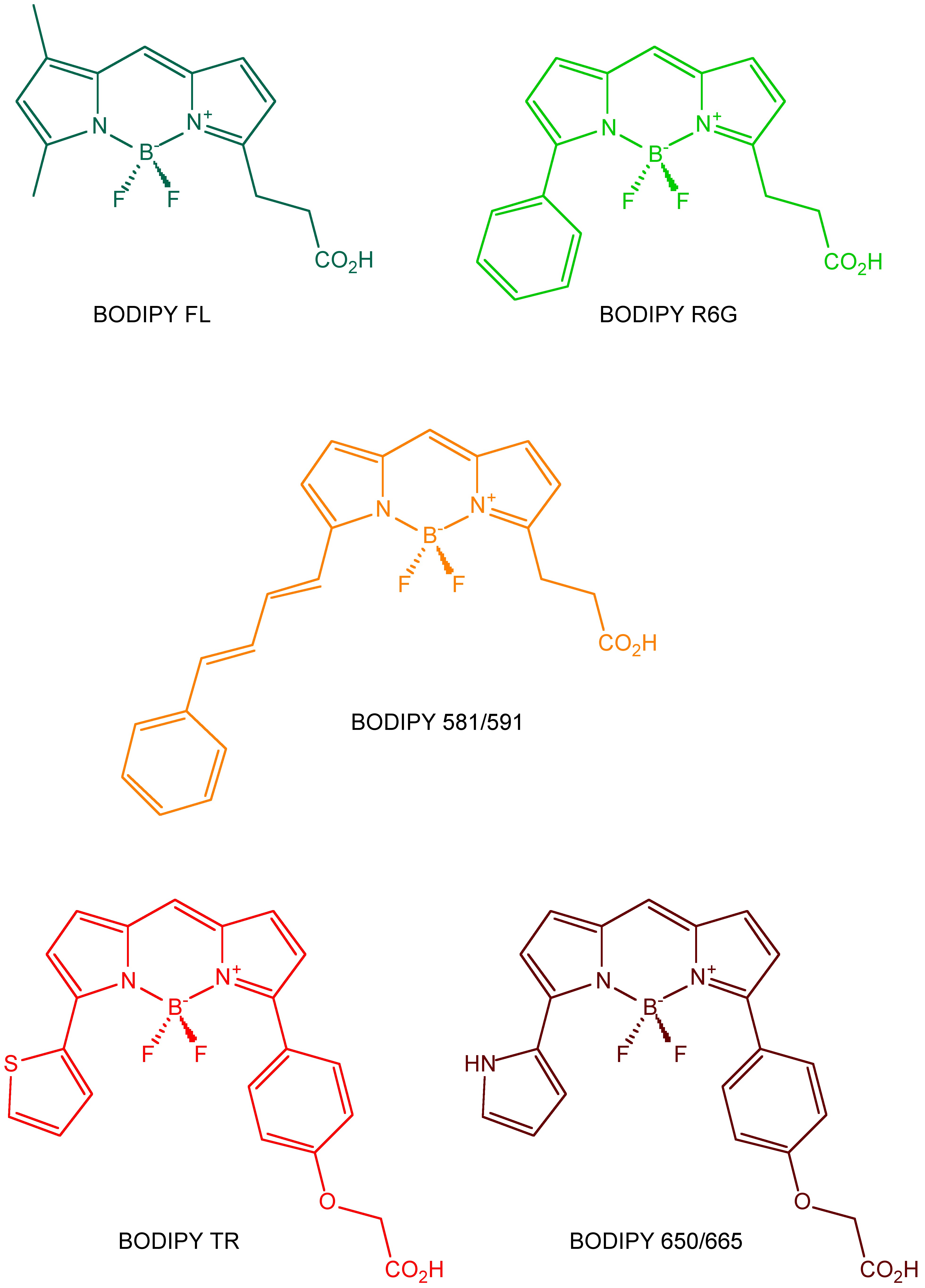
La mayoría de las biomoléculas son no fluorescentes, por lo que es necesario conectar diferentes fluoróforos para permitir el marcaje o seguimiento de las biomoléculas. Por ejemplo, el ADN es un ejemplo de una biomolécula sin fluorescencia. Las familias Rodamina (Figura\(\PageIndex{14}\)) y BODIPY (Figura\(\PageIndex{15}\)) son dos tipos de fluoróforos orgánicos bien desarrollados. Han sido ampliamente empleados en el diseño de sondas moleculares debido a sus excelentes propiedades fotofísicas.
Tintes rojos e infrarrojos cercanos (NIR)
Con el desarrollo de fluoróforos, los tintes rojo e infrarrojo cercano (NIR) atraen cada vez más la atención ya que pueden mejorar la sensibilidad de la detección de fluorescencia. En el sistema biológico, la autofluorescencia siempre aumenta la relación señal/ruido (S/N) y limita la sensibilidad. A medida que la longitud de onda de excitación se vuelve más larga, la autopfluorescencia disminuye en consecuencia, y por lo tanto la relación señal-ruido aumenta Las cianinas son uno de esos grupos de colorantes de longitud de onda larga, por ejemplo, Cy-3, Cy-5 y Cy-7 (Figura\(\PageIndex{16}\)), que tienen emisión a 555, 655 y 755 nm respectivamente.
Fluoróforos de larga duración
Casi todos los fluoróforos mencionados anteriormente son fluoróforos orgánicos que tienen una vida útil relativamente corta de 1-10 ns. Sin embargo, también hay algunos fluoróforos orgánicos de larga vida, como el pireno y el coroneno con una vida útil cercana a 400 ns y 200 ns respectivamente (Figura\(\PageIndex{17}\)). La larga vida útil es una de las propiedades importantes de los fluoróforos. Con su ayuda, la autofluorescencia en el sistema biológico se puede eliminar adecuadamente, y de ahí mejorar la detectabilidad sobre el fondo.
Aunque su emisión pertenece a la fosforescencia, los complejos de metales de transición son una clase significativa de fluoróforos de larga duración. El rutenio (II), el iridio (III), el renio (I) y el osmio (II) son los metales de transición más populares que pueden combinarse con uno a tres ligandos de diimina para formar complejos metálicos fluorescentes. Por ejemplo, el iridio forma un complejo catiónico con dos fenilpiridina y un ligando de diimina (Figura\(\PageIndex{18}\)). Este complejo tiene un excelente rendimiento cuántico y una vida útil relativamente larga.
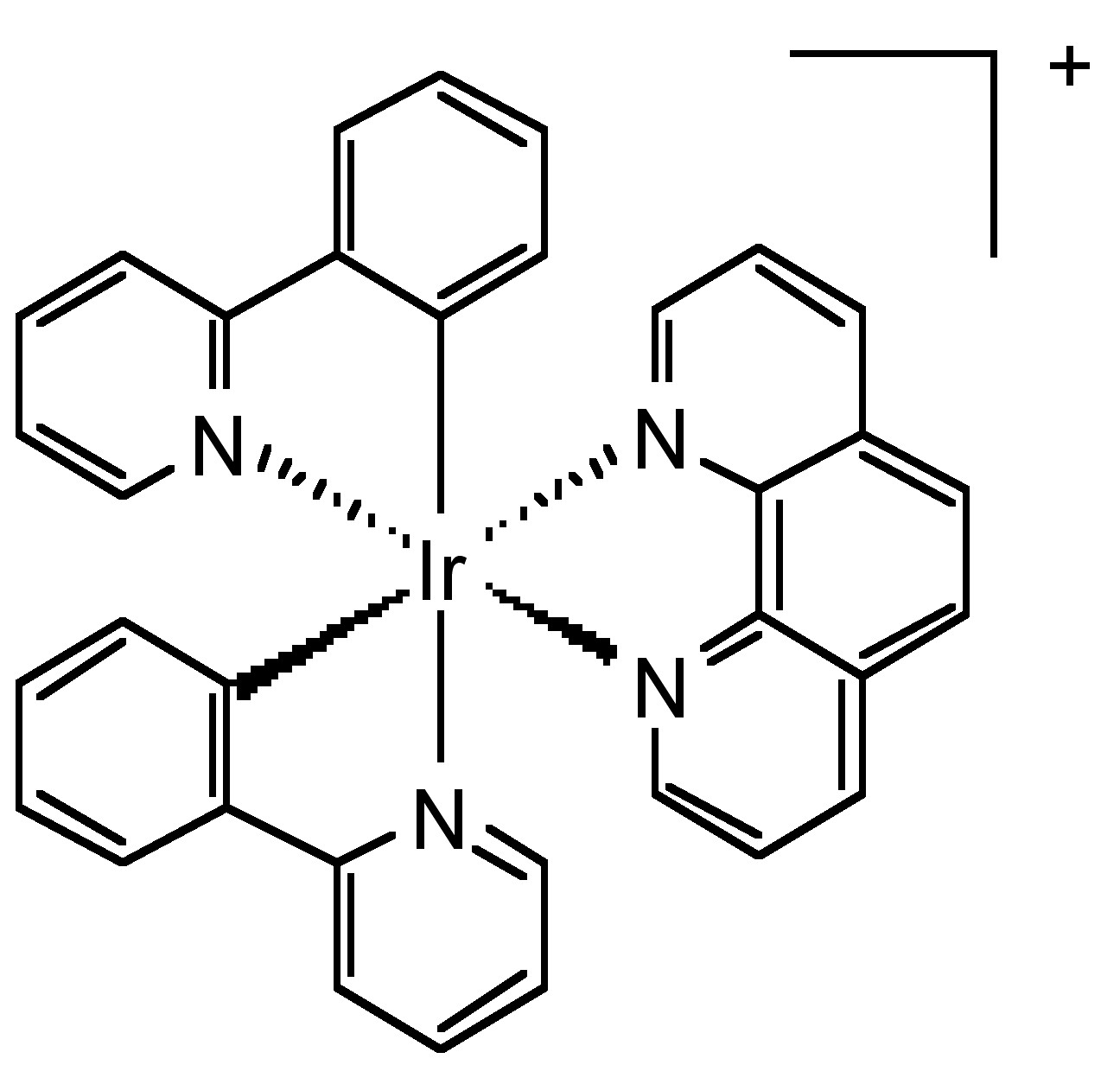
Aplicaciones
Con los avances en fluorómetros y fluoróforos, la fluorescencia ha sido una teconología dominante en el campo médico, como el diagnóstico clínico y la citometría de flujo. Aquí se discute la aplicación de fluorescencia en la detección de ADN y ARN.
La baja concentración de secuencias de ADN y ARN en las células determina que se requiere una alta sensibilidad de la sonda, mientras que la existencia de diversos ADN y ARN con estructuras similares requiere una alta selectividad. De ahí que los fluoróforos se introdujeran como grupo señal en las sondas, debido a que la espectroscopia de fluorescencia es la tecnología más sensible hasta ahora.
El diseño general de una sonda de ADN o ARN implica el uso de un oligonucleótido de hibridación antisentido para monitorear la secuencia de ADN diana. Cuando el oligonucleótido está conectado con el ADN diana, los grupos de señal, los fluoróforos, emiten fluorescencia diseñada. Con base en la espectroscopia de fluorescencia, se puede detectar fluorescencia de señal que nos ayuda a localizar la secuencia de ADN diana. La selectividad inherente a la hibridación entre dos secuencias complementarias de ADN/ARN hacen de este tipo de sondas de ADN una selectividad extremadamente alta. Una baliza molecular es un tipo de sondas de ADN. Este diseño simple pero novedoso es reportado por Tyagi y Kramer en 1996 (Figura\(\PageIndex{19}\)) y poco a poco se desarrolló para ser una de las sondas de ADN/ARN más comunes.
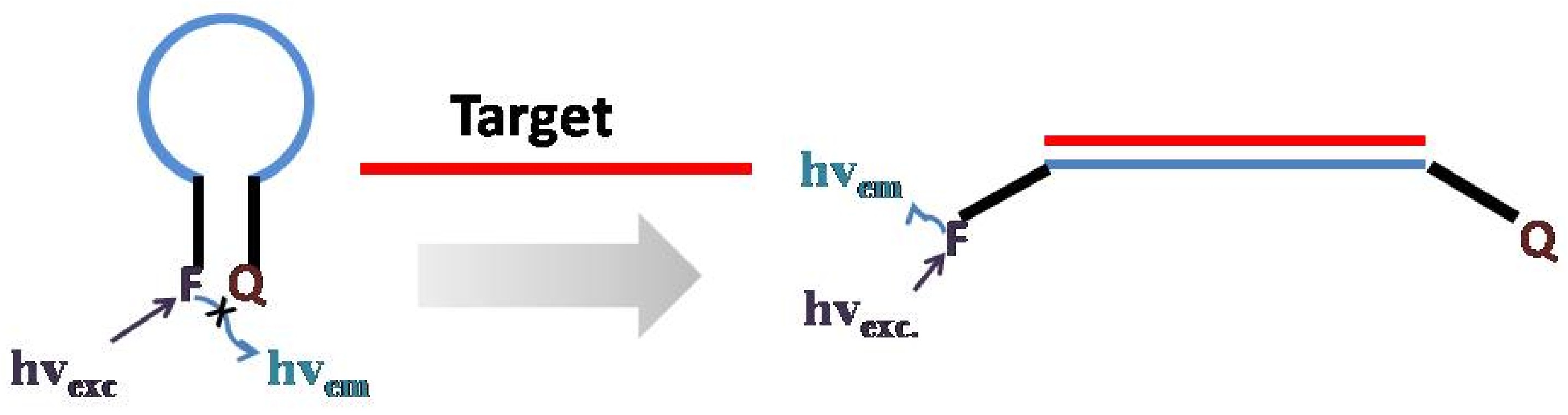
En términos generales, una baliza molecular se compone de tres partes: un oligonucleótido, un fluoróforo y un extintor en diferentes extremos. En ausencia del ADN diana, la baliza molecular se pliega como una horquilla debido a la interacción entre los dos nucleótidos de la serie en extremos opuestos del oligonucleótido. En este momento, la fluorescencia es apagada por el extintor cercano. Sin embargo, en presencia de la diana, la región sonda del MB hibridará con el ADN diana, abrirá el MB plegado y separará el fluoróforo y el extintor. Por lo tanto, se puede detectar la señal fluorescente lo que indica la existencia de un ADN particular.
Espectroscopia de correlación de fluorescencia
La espectroscopia de correlación de fluorescencia (FCS) es una técnica experimental que mide las fluctuaciones en la intensidad de fluorescencia causadas por el movimiento browniano de las partículas. La fluorescencia es una forma de luminiscencia que implica la emisión de luz por una sustancia que ha absorbido luz u otra radiación electromagnética. El movimiento browniano es el movimiento aleatorio de partículas suspendidas en un fluido que resulta de colisiones con otras moléculas o átomos en el fluido. Los datos experimentales iniciales se presentan como intensidad a lo largo del tiempo pero el análisis estadístico de las fluctuaciones permite determinar diversas propiedades físicas y fotofísicas de moléculas y sistemas. Cuando se combina con modelos de análisis, el FCS se puede utilizar para encontrar coeficientes de difusión, radios hidrodinámicos, concentraciones promedio, velocidades de reacción química cinética y dinámica de estado de triplete simple. Los estados singlete y triplete están relacionados con el espín electrónico. Los electrones pueden tener un giro de (+1/2) o (-1/2). Para un sistema que existe en el estado singlete, todos los giros se emparejan y el giro total para el sistema es ((-1/2) + (1/2)) o 0. Cuando un sistema está en el estado triplete, existen dos electrones desapareados con un estado de giro total de 1.
Historia
Los primeros científicos en ser acreditados con la aplicación de fluorescencia a técnicas de correlación de señales fueron Douglas Magde, Elliot L. Elson y Walt W.Webb, por lo que comúnmente se les conoce como los inventores de FCS. La técnica se utilizó originalmente para medir la difusión y unión del bromuro de etidio (Figura\(\PageIndex{20}\)) sobre ADN bicatenario.
Inicialmente, la técnica requirió altas concentraciones de moléculas fluorescentes y fue muy insensible. A partir de 1993, se realizaron grandes mejoras en la tecnología y el desarrollo de microscopía confocal y microscopía de dos fotones, lo que permitió grandes mejoras en la relación señal/ruido y la capacidad de hacer detección de una sola molécula. Recientemente, las aplicaciones de FCS se han ampliado para incluir el uso de la Transferencia de Energía de Resonancia de Förster (FRET), la correlación cruzada entre dos canales fluorescentes en lugar de la autocorrelación, y el uso de escaneo láser. Hoy en día, el FCS se utiliza principalmente para biología y biofísica.
Instrumentación
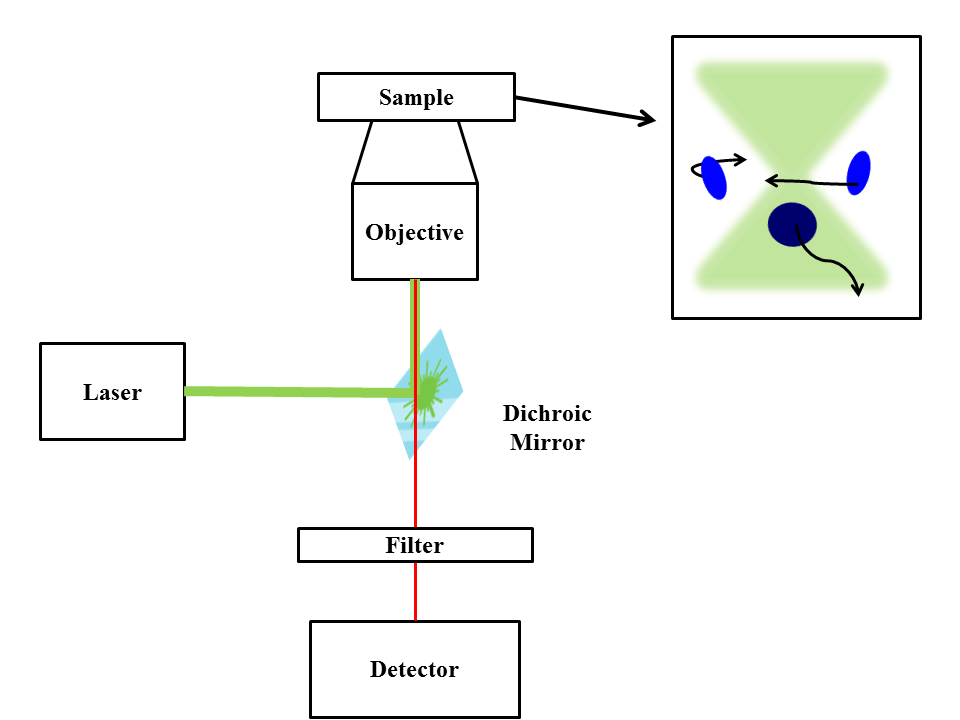
Una configuración básica de FCS (Figura\(\PageIndex{21}\)) consiste en una línea láser que es reflejada en un objetivo de microscopio por un espejo dicroico. El rayo láser se enfoca sobre una muestra que contiene cantidades muy diluidas de partículas fluorescentes de manera que solo unas pocas partículas atraviesan el espacio observado en un momento dado. Cuando las partículas cruzan el volumen focal (el espacio observado) emiten fluorescencia. Esta luz es recogida por el objetivo y pasa a través del espejo dicroico (la luz recolectada se desplaza al rojo con relación a la luz de excitación), llegando al detector. Es esencial utilizar un detector con alta eficiencia cuántica (porcentaje de fotones que golpean el detector que produce portadores de carga). Los tipos comunes de detectores son un tubo fotomultiplicador (raramente utilizado debido al bajo rendimiento cuántico), un fotodiodo de avalancha y un fotodetector de nanocables superconductores. El detector produce una señal electrónica que se puede almacenar como intensidad a lo largo del tiempo o puede correlacionarse automáticamente de inmediato. Es común usar dos detectores y correlacionar sus salidas, lo que lleva a una función de correlación cruzada que es similar a la función de autocorrelación pero que está libre de pospulsación (cuando un fotón emite dos pulsos electrónicos). Como se mencionó anteriormente, cuando se combinan con modelos de análisis, los datos de FCS pueden ser utilizados para encontrar coeficientes de difusión, radios hidrodinámicos, concentraciones promedio, velocidades de reacción química cinética y dinámica de triplete simple.
Análisis
Cuando las partículas pasan por el volumen observado y emiten fluorescencia, pueden describirse matemáticamente como funciones de dispersión puntual, siendo el punto de la fuente de luz el centro de la partícula. Una función de dispersión puntual (PSF) se describe comúnmente como un elipsoide con mediciones en el rango de cientos de nanómetros (aunque no siempre es el caso dependiendo de la partícula). Con respecto a la microscopía confocal, el PSF se aproxima bien por un gaussiano,\ ref {1}, donde I 0 es la intensidad pico, r y z son posición radial y axial, y w xy y w z son los radios radial y axial (con w z > w xy).
\[ PSF(r,z) \ =\ I_{0} e^{-2r^{2}}/\omega^{2}_{xy}e^{-2z^{2}/\omega^{2}_{z}} \label{1} \]
Este gaussiano se asume con la autocorrelación con cambios que se aplican a la ecuación cuando es necesario (como el caso de un estado triplete, relajación química, etc.). Para una PSF gaussiana, la función de autocorrelación viene dada por\ ref {2}, donde\ ref {3} es el desplazamiento estocástico en el espacio de un fluoróforo después del tiempo T.
\[ G(\tau )\ =\frac{1}{\langle N \rangle } \langle exp (- \frac{\Delta (\tau)^{2} \ +\ \Delta Y(\tau )^{2}}{w^{2}_{xy}}\ -\ \frac{\Delta Z(\tau )^{2}}{w^{2}_{z}}) \rangle \label{2} \]
\[ \Delta \vec{R} (\tau )\ =\ (\Delta X(\tau ), \Delta (\tau ), \Delta (\tau )) \label{3} \]
La expresión es válida si el número promedio de partículas, N, es bajo y si se pueden ignorar los estados oscuros. Debido a esto, FCS observa un pequeño número de moléculas (concentraciones nanomolares y picomolares), en un pequeño volumen (~1μm 3) y no requiere procesos de separación física, ya que la información se determina mediante óptica. Después de aplicar la función de autocorrelación elegida, resulta mucho más fácil analizar los datos y extraer la información deseada (Figura\(\PageIndex{22}\)).
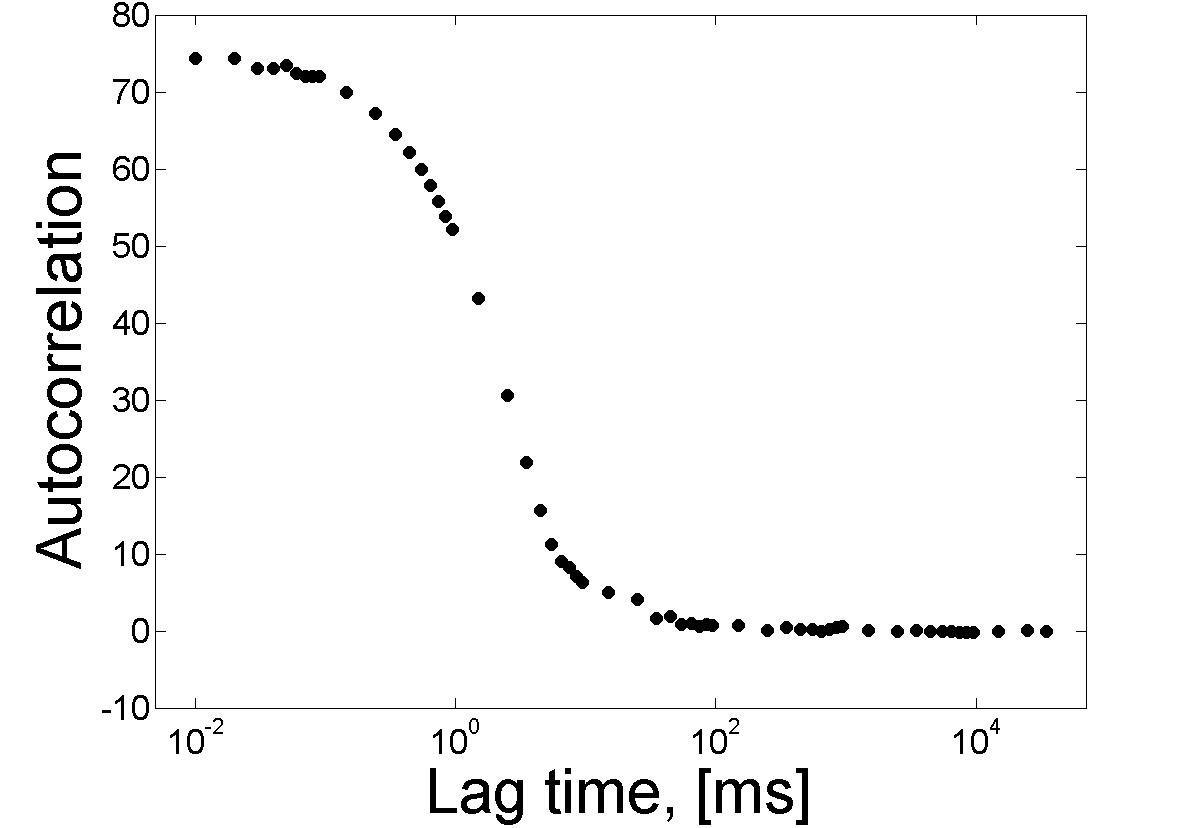
Aplicación
El FCS se ve frecuentemente en el contexto de la microscopía, siendo utilizado en microscopía confocal y microscopía de excitación de dos fotones. En ambas técnicas, la luz se enfoca en una muestra y las fluctuaciones de intensidad de fluorescencia se miden y analizan mediante autocorrelación temporal. La magnitud de la intensidad de la fluorescencia y la cantidad de fluctuación está relacionada con el número de partículas individuales; existe un tiempo óptimo de medición cuando las partículas entran o salen del volumen de observación. Cuando demasiadas partículas ocupan el espacio observado, las fluctuaciones generales son pequeñas en relación con la señal total y son difíciles de resolver. Por otro lado, si el tiempo entre las moléculas que pasan por el espacio observado es demasiado largo, ejecutar un experimento podría llevar una cantidad de tiempo irrazonable. Una de las aplicaciones de FCS es que se puede utilizar para analizar la concentración de moléculas fluorescentes en solución. Aquí, se utiliza FCS para analizar un espacio muy pequeño que contiene un pequeño número de moléculas y se observa el movimiento de las partículas de fluorescencia. La intensidad de fluorescencia fluctúa en función del número de partículas presentes; por lo tanto, el análisis puede dar el número promedio de partículas presentes, el tiempo promedio de difusión, la concentración y el tamaño de partícula. Esto es útil porque se puede hacer in vivo, permitiendo el estudio práctico de diversas partes de la célula. El FCS también es una técnica común en la fotofísica, ya que se puede utilizar para estudiar la formación del estado de tripletes y el fotoblanqueo. La formación de estado se refiere a la transición entre un estado singlete y un triplete, mientras que el fotoblanqueo es cuando un fluoróforo se altera fotoquímicamente de tal manera que pierde permanentemente su capacidad de fluorescencia. Con mucho, la aplicación más popular del FCS es su uso en el estudio de la unión molecular y la desunión a menudo, no es una molécula en particular la que es de interés sino, más bien, la interacción de esa molécula en un sistema. Al marcar con colorante una molécula particular en un sistema, el FCS puede usarse para determinar la cinética de unión y desunión (particularmente útil en el estudio de ensayos).
Principales ventajas y limitaciones
| Ventaja | Limitación |
|---|---|
| Se puede utilizar in vivo | Puede ser ruidoso dependiendo del sistema |
| Muy sensible | No funciona si la concentración de tinte es demasiado alta |
| La misma instrumentación puede realizar diversos tipos de experimentos | Los datos brutos no dicen mucho, se deben aplicar modelos de análisis |
| Se ha utilizado en diversos estudios, se ha realizado un amplio trabajo para establecer la técnica | Si el sistema se desvía sustancialmente del ideal, los modelos de análisis pueden ser difíciles de aplicar (haciendo que las correcciones sean difíciles de calcular). |
| Se puede extraer una gran cantidad de información | Puede requerir más cálculos para aproximar el PSF, dependiendo de la forma particular. |
Espectroscopía de Fosforescencia Molecular
Cuando un material que ha sido irradiado emite luz, puede hacerlo ya sea vía incandescencia, en la que todos los átomos del material emiten luz, o vía luminiscencia, en la que solo ciertos átomos emiten luz, Figura\(\PageIndex{23}\). Hay dos tipos de luminiscencia: fluorescencia y fosforescencia. La fosforescencia ocurre cuando los electrones excitados de una multiplicidad diferente de aquellos en su estado fundamental regresan a su estado fundamental a través de la emisión de un fotón, Figura\(\PageIndex{24}\). Es un tipo de luminiscencia más duradero y menos común, ya que es un proceso prohibido por centrifugado, pero encuentra aplicaciones en numerosos campos diferentes. Este módulo cubrirá las bases físicas de la fosforescencia, así como la instrumentación, preparación de muestras, limitaciones y aplicaciones prácticas relacionadas con la espectroscopia de fosforescencia molecular.
Fosforescencia
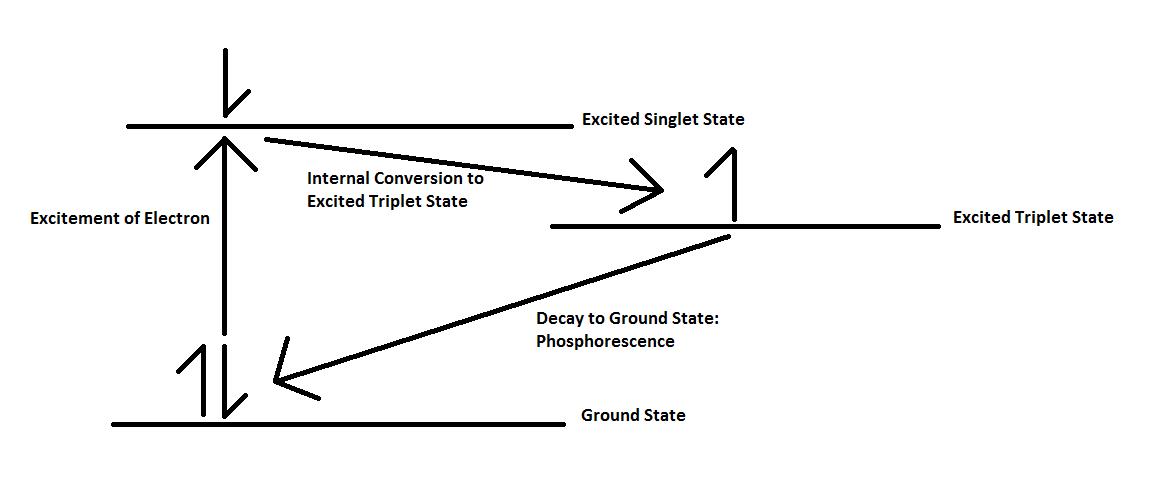
La fosforescencia es la emisión de energía en forma de fotón después de que un electrón ha sido excitado debido a la radiación. Para entender la causa de esta emisión, primero es importante considerar el estado electrónico molecular de la muestra. En el estado electrónico molecular singlete, todos los espines electrónicos están emparejados, lo que significa que sus espines son antiparalelos entre sí. Cuando un electrón emparejado se excita a un estado de mayor energía, puede ocupar un estado singlete excitado o un estado triplete excitado. En un estado singlete excitado, el electrón excitado permanece emparejado con el electrón en el estado fundamental. En el estado triplete excitado, sin embargo, el electrón se desaparea con el electrón en estado fundamental y adopta un espín paralelo. Cuando ocurre esta conversión de espín, se dice que el electrón en el estado triplete excitado es de una multiplicidad diferente del electrón en el estado fundamental. La fosforescencia ocurre cuando los electrones del estado triplete excitado regresan al estado singlete básico,\ ref {4} -\ ref {6}, donde E representa un electrón en el estado básico singlete, E* representa el electrón en el estado excitado singlete y T* representa el electrón en el estado excitado triplete.
\[ E\ +\ hv \rightarrow E* \label{4} \]
\[ E* \rightarrow T* \label{5} \]
\[T* \rightarrow \ E\ +\ hv' \label{6} \]
Los electrones en el estado triplete excitado tienen prohibido el regreso al estado singlete porque son paralelos a los que se encuentran en el estado fundamental. Para regresar al estado fundamental, deben someterse a una conversión de giro, lo cual no es muy probable, sobre todo considerando que existen muchos otros medios para liberar el exceso de energía. Debido a la necesidad de una conversión interna de espín, las vidas de fosforescencia son mucho más largas que las de otros tipos de luminiscencia, durando de 10 -4 a 10 4 segundos.
Históricamente, la fosforescencia y la fluorescencia se distinguieron por la cantidad de tiempo después de que se eliminó la fuente de radiación que quedó luminiscencia. La fluorescencia se definió como quimioluminiscencia de corta duración (< 10 -5 s) debido a la facilidad de transición entre los estados singlete excitado y molido, mientras que la fosforescencia se definió como quimioluminiscencia de vida más larga. Sin embargo, basar la diferencia entre las dos formas de luminiscencia puramente en el tiempo resultó ser una métrica muy poco confiable. La fluorescencia ahora se define como que ocurre cuando los electrones en descomposición tienen la misma multiplicidad que los de su estado fundamental.
Preparación de muestras
Debido a que la fosforescencia es poco probable y produce emisiones relativamente débiles, las muestras que utilizan espectroscopía de fosforescencia molecular deben prepararse con mucho cuidado para maximizar la fosforescencia observada. El método más común de preparación de muestras de fosforescencia es disolver la muestra en un disolvente que formará un sólido transparente e incoloro cuando se enfríe a 77 K, la temperatura del nitrógeno líquido. Generalmente se utilizan condiciones criogénicas porque, a bajas temperaturas, hay poca interferencia de fondo de procesos distintos a la fosforescencia que contribuyen a la pérdida de energía absorbida. Adicionalmente, hay poca interferencia del propio solvente bajo condiciones criogénicas. La elección del disolvente es especialmente importante; para formar un sólido transparente e incoloro, el disolvente debe ser de pureza ultra alta. La polaridad de la muestra fosforescente motiva la elección del disolvente. Los solventes comunes incluyen etanol para muestras polares y EPA (una mezcla de éter dietílico, isopentano y etanol en una proporción de 5:5:2) para muestras no polares. Una vez que se ha formado un disco a partir de la muestra y el disolvente, se puede analizar mediante un fosforoscopio.
Fosforescencia a temperatura ambiente
Si bien el uso de un medio rígido sigue siendo la opción predominante para medir la fosforescencia, se han producido avances recientes en la espectroscopia a temperatura ambiente, lo que permite medir muestras a temperaturas más cálidas. Similar a la preparación de la muestra usando un medio rígido para la detección, el aspecto más importante es maximizar la fosforescencia registrada evitando otras formas de emisión. Los métodos actuales para permitir una buena detección de fosforescencia en la habitación incluyen absorber la muestra sobre un soporte externo y colocar la muestra en un recinto molecular, los cuales protegerán el estado triplete involucrado en la fosforescencia.
Instrumentación y Medición
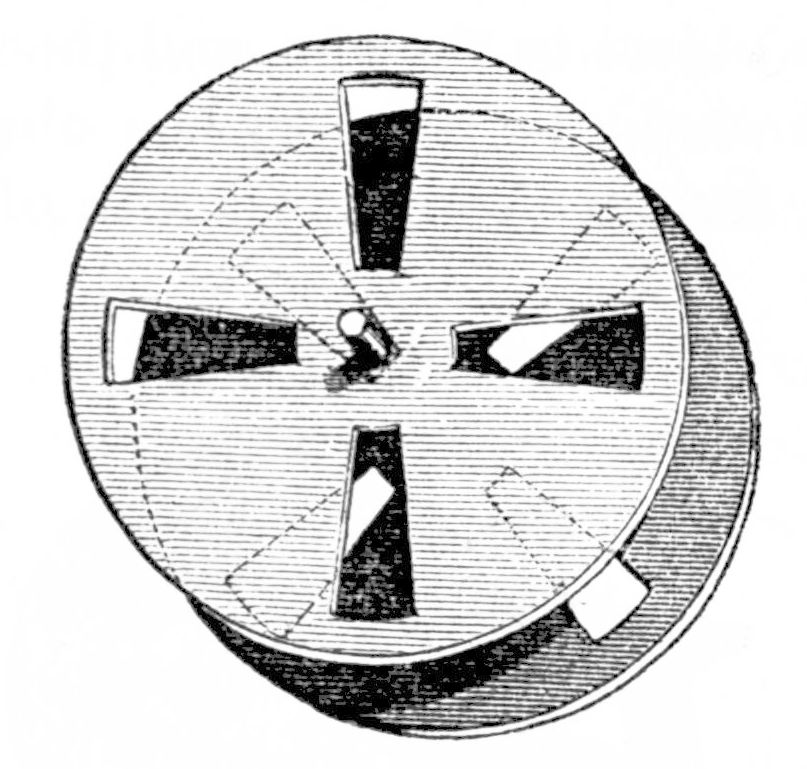
La fosforescencia se registra en dos métodos distintos, siendo la característica distintiva entre los dos métodos si la fuente de luz es constante o pulsada o no. Cuando la fuente de luz es estable, se utiliza un fosforoscopio o un accesorio a un espectrómetro de fluorescencia. El fosforoscopio fue ideado experimentalmente por Alexandre-Edmond Becquerel, pionero en el campo de la luminiscencia, en 1857, Figura\(\PageIndex{25}\).

Hay dos tipos diferentes de fosforoscopios: los fosforoscopios de disco giratorio y los fosforoscopios de lata giratoria. Un fosforoscopio de disco giratorio\(\PageIndex{26}\), Figura, comprende dos discos giratorios con orificios, en el medio de los cuales se coloca la muestra a analizar. Después de que un haz de luz penetra en uno de los discos, la muestra es excitada electrónicamente por la energía lumínica y puede fosforescencia; un fotomultiplicador registra la intensidad de la fosforescencia. Cambiar la velocidad de rotación de los discos permite crear una curva de decaimiento, que le dice al usuario cuánto dura la fosforescencia.
El segundo tipo de fosforoscopio, el fosforoscopio de lata giratoria, emplea un cilindro giratorio con una ventana para permitir el paso de la luz, Figura\(\PageIndex{27}\). La muestra se coloca en el borde exterior de la lata y, cuando se permite que la luz de la fuente pase a través de la ventana, la muestra se excita electrónicamente y fosforescencia, y la intensidad se vuelve a detectar vía fotomultiplicador. Una gran ventaja del fosforoscopio de lata giratoria sobre el fosforoscopio de disco giratorio es que, a altas velocidades, puede minimizar otros tipos de interferencias como la fluorescencia y la dispersión Raman y Rayleigh, la dispersión inelástica y elástica de fotones, respectivamente.

La medición más moderna y avanzada de la fosforescencia utiliza espectrometría resuelta en el tiempo de fuente pulsada y se puede medir en un espectrómetro de luminiscencia. Un espectrómetro de luminiscencia tiene modos tanto para fluorescencia como para fosforescencia, y el espectrómetro puede medir la intensidad de la longitud de onda con respecto ya sea a la longitud de onda de la luz emitida o al tiempo, Figura\(\PageIndex{28}\).
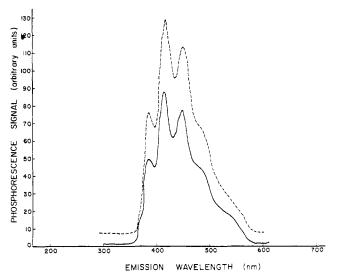
El espectrómetro emplea un fotomultiplador de puerta para medir la intensidad de la fosforescencia. Después del estallido inicial de radiación de la fuente de luz, la puerta bloquea más luz, y el fotomultiplicador mide tanto la intensidad máxima de fosforescencia como la decaimiento, como se muestra en la Figura\(\PageIndex{29}\).
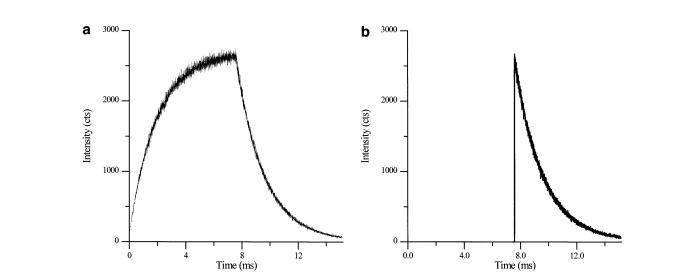
La vida útil de la fosforescencia se puede calcular a partir de la pendiente de la decaimiento de la muestra después de la intensidad máxima. La vida útil depende de muchos factores, incluyendo la longitud de onda de la radiación incidente, así como las propiedades que surgen de la muestra y el disolvente utilizado. Aunque la fluorescencia de fondo, así como la dispersión Raman y Rayleigh todavía están presentes en la espectrometría resuelta de fuente pulsada en tiempo, se detectan y eliminan fácilmente de las gráficas de intensidad versus tiempo, lo que permite la medición pura de la fosforescencia.
Limitaciones
La mayor limitación de la espectroscopia de fosforescencia molecular es la necesidad de condiciones criogénicas. Esto es un resultado directo de la transición desfavorable de un estado triplete excitado a un estado singlete básico, que es poco probable y por lo tanto produce irradiación de baja intensidad, difícil de detectar y de larga duración. Debido a que el enfriamiento de muestras fosforescentes reduce la posibilidad de otros procesos de irradiación, es vital para las formas actuales de espectroscopia de fosforescencia, pero esto la hace poco práctica en entornos fuera de un laboratorio especializado. Sin embargo, la aparición y desarrollo de métodos de espectroscopia a temperatura ambiente dan lugar a un nuevo conjunto de aplicaciones y hacen de la espectroscopía de fosforescencia un método más viable.
Aplicaciones prácticas
Actualmente, los materiales fosforescentes tienen una variedad de usos, y la espectrometría de fosforescencia molecular es aplicable en muchas industrias. Los materiales fosforescentes encuentran uso en pantallas de radar, juguetes que brillan en la oscuridad y en pigmentos, algunos de los cuales se utilizan para hacer visibles las señales de las carreteras para los conductores. La espectroscopia de fosforescencia molecular está actualmente en uso en la industria farmacéutica, donde su alta selectividad y falta de necesidad de amplias etapas de separación o purificación la hacen útil. También muestra potencial en el análisis forense debido al bajo requerimiento de volumen de muestra.


