4.2: Microbioma intestinal y cerebro
- Page ID
- 121889
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Disbiosis
Como se señaló anteriormente en el Capítulo 1, un estado de desequilibrio microbiano dentro del cuerpo conocido como disbiosis, recientemente se ha relacionado con el desarrollo de muchas enfermedades y trastornos. Estos incluyen obesidad, cáncer colorrectal y enfermedades cardiovasculares. Por lo tanto, hay evidencia creciente y sustancial de que la homeostasis de la microbiota intestinal es esencial para la salud humana. El ejercicio, la dieta, el uso de antibióticos y la higiene personal son factores importantes para mantener este equilibrio.
Hay varias formas en las que la microbiota intestinal interactúa con el cerebro. Los componentes de las bacterias, como los lipopolisacáridos, activan el sistema inmune innato. En la disbiosis, el sistema inmune innato es hiperactivo, lo que puede provocar inflamación del sistema nervioso central. También se ha encontrado que ciertos metabolitos derivados de bacterias, como el ácido D-láctico y el amoníaco, tienen efectos neurotóxicos. Además de estos metabolitos, muchas bacterias intestinales interactúan con el cerebro a través de la producción de neurotransmisores, como la serotonina y la dopamina. Finalmente, la microbiota intestinal se comunica con el cerebro a través del nervio vago, que conecta el tronco encefálico con el corazón, los pulmones y el tracto digestivo (Galland, 2014).
También se ha encontrado que la disbiosis juega un papel en varios trastornos neurológicos y psiquiátricos, como el trastorno depresivo mayor, la enfermedad de Parkinson y la enfermedad de Alzheimer. Muchas de estas enfermedades y trastornos suelen ser comórbidos con trastornos gastrointestinales. En algunos casos (por ejemplo, la enfermedad de Parkinson), es posible inducir la enfermedad en un animal sano exponiéndola a la microbiota intestinal de un humano enfermo. Se ha demostrado que el intestino y el cerebro se comunican bidireccionalmente, pero este vínculo y el mecanismo detrás de él no se entienden completamente.
Estudio de caso: Microbioma intestinal, cerebro y enfermedad de Parkinson
Evidencia de interacciones entre el intestino y el cerebro
Tradicionalmente, las enfermedades neurológicas se han estudiado únicamente a través del lente de problemas que ocurren dentro del SNC, aunque teniendo en cuenta que las influencias periféricas se han visto implicadas en la aparición y/o progresión de enfermedades que impactan al cerebro. Una de estas influencias periféricas que ha ido ganando cada vez más interés en el impacto que el microbioma intestinal tiene en el cerebro (Dinan y Cryan, 2015). Los datos emergentes sugieren la comunicación bidireccional entre el intestino y el cerebro en la ansiedad, la depresión, la nocicepción y el trastorno del espectro autista (TEA).
La fisiología y motilidad gastrointestinal (GI) están influenciadas por señales que surgen tanto localmente dentro del intestino como del SNC, lo que sugiere que tal interacción sinérgica podría existir. Los neurotransmisores, la señalización inmune, las hormonas y los neuropéptidos producidos dentro del intestino pueden, a su vez, impactar en el cerebro (Selkrig et al., 2014, Wall et al., 2014) pero aún permanecen en gran parte desconocidos.
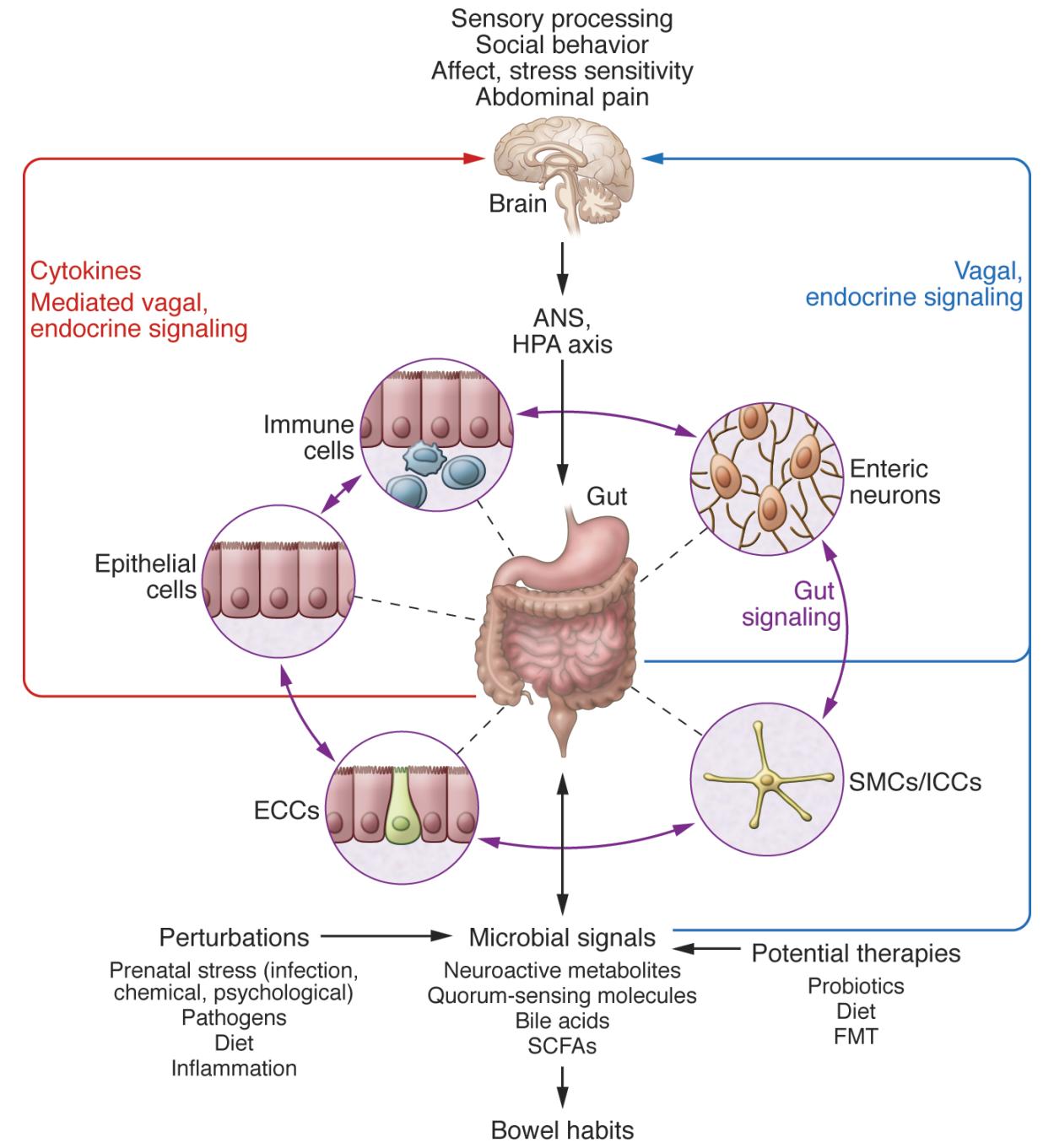
Figura\(\PageIndex{1}\). (tomado de opensource https://www.jci.org/articles/view/76304/figure/3) Una red de células dianas/transductoras especializadas en la pared intestinal funciona como una interfaz entre la microbiota y la luz del huésped. En respuesta a demandas externas y corporales, el cerebro modula estas células especializadas dentro de esta red a través de las ramas de la ANS (eferentes simpáticos y parasimpáticos/vagales) y el eje HPA. Dicha modulación puede ser transitoria, como en respuesta a perturbaciones transitorias, o de larga duración, como en respuesta a la producción cerebral alterada crónicamente. La microbiota está en constante comunicación bidireccional con esta interfaz a través de múltiples vías de señalización microbiana, y esta comunicación se modula en respuesta a perturbaciones de la microbiota o del cerebro. La salida integrada de la interfaz microbio-cerebro intestinal se transmite de nuevo al cerebro a través de múltiples vías de señalización aferentes, incluyendo endocrina (metabolitos, citocinas y moléculas de señalización microbiana) y neurocrina (aferentes vagales y espinales). Si bien las alteraciones agudas en esta retroalimentación interoceptiva pueden resultar en cambios cerebrales funcionales transitorios (infecciones GI), las alteraciones crónicas se asocian con cambios neuroplásicos cerebrales. Las terapias potenciales tienen como objetivo normalizar la señalización alterada de la microbiota al ENS y al sistema nervioso central. FMT, trasplante microbiano fecal; ICC, célula intersticial de Cajal.
La investigación está comenzando a descubrir los profundos impactos que la microbiota puede tener en el neurodesarrollo y el SNC (Sharon et al., 2016). Los ratones libres de gérmenes (GF) y los ratones libres de patógenos específicos (SPF) tratados con antibióticos muestran alteraciones en la neurogénesis del hipocampo, lo que resulta en un reconocimiento espacial y de objetos alterado (Möhle et al., 2016). Se ha demostrado que la microbiota intestinal regula la expresión del receptor 5-hidroxitriptamina (5-HT1A), el factor neurotrópico derivado del cerebro (BDNF) y la subunidad 2 del receptor NMDA (NR2A) (Bercik et al., 2011, Diaz Heijtz et al., 2011, Sudo et al., 2004). La microbiota promueve la producción de serotonina entérica y circulante en ratones (Yano et al., 2015) y afecta la ansiedad, hiperactividad y cognición (Clarke et al., 2013, Diaz Heijtz et al., 2011, Neufeld et al., 2011, Selkrig et al., 2014).
Disbiosis en Neurodegeneración
Se ha reportado disbiosis del microbioma humano en sujetos diagnosticados con diversas enfermedades neurológicas. Por ejemplo, se ha encontrado que los microbios intestinales fecales y asociados a la mucosa son diferentes entre individuos con Enfermedad de Parkinson (EP) y controles sanos aunque no está claro cuál es este vínculo.
Los individuos con EP también tienden a presentar inflamación intestinal y anomalías gastrointestinales como estreñimiento que a menudo preceden a los defectos motores clínicos por muchos años (Braak et al., 2003, Verbaan et al., 2007). Una teoría (la hipótesis de Braak) ha sugerido que la acumulación aberrante de αSyn se inicia primero dentro del intestino y luego se propaga a través del nervio vago al cerebro en un mecanismo que se asemeja a enfermedades priones donde las proteínas infecciosas se propagan de una zona a otra (Del Tredici y Braak, 2008). Una característica distintiva de la EP involucra las inclusiones de αSYN (alfa sinucleína), y éstas aparecen tempranamente en el sistema nervioso entérico (ENS) y los nervios glosofaríngeo y vagal (Braak et al., 2003, Shannon et al., 2012) .Curiosamente, los individuos vagotomizados (donde el nervio vago ha sido cortado quirúrgico) están reducidos riesgo de EP (Svensson et al., 2015). Esto sugiere que hay evidencia de que en la EP una alteración en el microbioma intestinal podría producir de alguna manera neurodegeneración en el cerebro, y que este factor viaja a lo largo del nervio vago.
¿Cómo probarías esto? ¿Qué tendría que hacer un investigador?
- ¿Pueden las bacterias intestinales regular los déficits motores distintivos y la fisiopatología de las sinucleinopatías como la EP?
- ¿Son necesarios cambios en la microbiota intestinal para promover la patología αSYN, la neuroinflamación y los rasgos motores característicos en un modelo adecuado de ratón?
- Intentar demostrar que los microbios intestinales pueden desempeñar un papel crítico y funcional en la patogénesis de sinucleinopatías como la EP
Artículos recientes que respondieron a todas las líneas de evidencia anteriores utilizaron ratones libres de gérmenes para examinar los efectos de la microbiota intestinal sobre la activación de la microglía en el cerebro. Además, se encontró que las bacterias intestinales modulan la activación de la microglía durante la infección viral a través de la producción de metabolitos microbianos, a saber, ácidos grasos de cadena corta (SCFA). Para abordar si los SCFA impactan las respuestas neuroinmunes en un modelo de ratón de EP, los animales fueron tratados con una mezcla de acetato, propionato y butirato de SCFA (mientras que los animales permanecieron microbiológicamente estériles). Estos resultados demostraron que el microbioma intestinal y los cambios en el microbioma intestinal podrían alterar la producción de SCFA que a su vez podrían indicar alterar la microglía cerebral y que este podría ser el vínculo mecanicista entre los microbiomas intestinales, la activación del sistema inmune y el daño al cerebro.
El principal efecto de las perturbaciones de la microbiota intestinal en el cerebro puede ocurrir en momentos de menor diversidad e inestabilidad de la microbiota intestinal (infantes y ancianos) y durante el desarrollo cerebral (periodo perinatal e infantil). Durante el periodo prenatal, el cerebro en desarrollo se expone primero a metabolitos maternos derivados del intestino y puede estar expuesto a microbios intrauterinos. Durante el parto, la microbiota intestinal del recién nacido está conformada por la microbiota vaginal (o cutánea) materna (revisada anteriormente). Aunque la posibilidad de que las influencias prenatales y postnatales en la microbiota puedan afectar el desarrollo cerebral es intrigante, no ha habido ninguna investigación en humanos que caracterice el efecto de la modulación de la microbiota materna en el desarrollo cerebral fetal y secuelas adultas de tal modulación que puedan sospecharse en la enfermedad del espectro autista. Una vez más, es intrigante considerar las posibilidades asociadas con los cambios en el microbioma intestinal de los ancianos y la aparición de afecciones neurodegenerativas, pero se necesita más investigación en esta nueva y emocionante área de investigación en neurociencia.
Referencias
- Galland, L. (2014). El microbioma intestinal y el cerebro. Revista de Alimentos Medicinales, 12, 1261-1272.


