4.3: El ejercicio y el cerebro
- Page ID
- 121882
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Visión general
Durante siglos, los investigadores han buscado dilucidar los mecanismos detrás del axioma de que un cuerpo sano conduce a una mente sana. Ahora se ha establecido que el ejercicio, incluso entre rutinas de ejercicio de mínimo compromiso, tiene una serie de efectos robustos en el cerebro, como memoria mejorada, estado de ánimo, funcionamiento cognitivo, plasticidad y capacidades de aprendizaje (Erickson et al., 2011; Spalding et al., 2011; Spalding et al., 2013; Phillips et al., 2014). Lo más destacado es que el ejercicio se ha visto implicado en tener efectos antidepresivos y contrarrestar enfermedades o trastornos mentales relacionados con la edad y atrofia, como la enfermedad de Alzheimer o la demencia (Laurin et al., 2001). Sin embargo, hasta hace poco, los intermediarios entre el ejercicio y sus beneficios para la salud no han sido bien entendidos.
Sin embargo, se ha demostrado que, contrariamente a la vieja noción de que el número de neuronas en el cerebro permanece estático después del desarrollo prenatal y neonatal, se pueden generar nuevas neuronas en el cerebro adulto a través de un proceso conocido como neurogénesis, que puede atenuar los efectos nocivos de la neurodegeneración ( van Praag et al., 1999). Este fenómeno se ha relacionado con el ejercicio, con una porción significativa del crecimiento neural posterior ocurriendo en la circunvolución dentada del hipocampo (Cotman y Berchtold, 2002). Dado que el hipocampo es crítico para la consolidación de la memoria y el aprendizaje, la generación de nuevas neuronas y el aumento de la plasticidad en esta región cerebral pueden explicar la mejora de la cognición y el estado emocional que acompaña al ejercicio (Gandy et al., 2017; Trinchero et al. ., 2017). Además, investigaciones preliminares han sugerido que la neurogénesis también puede ocurrir en muchas otras áreas del cerebro, incluyendo la amígdala y el hipotálamo, lo que puede explicar la diversidad de beneficios derivados del ejercicio (Fowler et al., 2008). Sin embargo, esta investigación no es tan extensa ni concluyente como la investigación de la neurogénesis del hipocampo, ni el grado en que ocurre la neurogénesis en otras regiones del cerebro es tan robusto como lo es en el hipocampo, con la excepción del bulbo olfativo (Cotman et al., 2007). Se ha demostrado que una molécula clave, el factor neurotrófico derivado del cerebro (BDNF), modula la neurogénesis y el ejercicio probablemente influye en los niveles del BDNF para alterar áreas del cerebro.
El ejercicio y la neurogénesis del hipocampo
En roedores, la neurogénesis del hipocampo en función del ejercicio ha sido ampliamente demostrada y replicada. Para probar esto, a los roedores se les inyecta bromodesoxiuridina (BrdU), que significa activamente células mitóticas y son incorporadas por células hijas, permitiendo así el rastreo de la división celular (del Río y Soriano, 1989). En algunos de los primeros trabajos en este campo, se demostró que los ratones a los que se les permitió hacer ejercicio voluntariamente sobre una rueda de carrera exhibieron una neurogénesis mejorada en la circunvolución dentada. Al utilizar BrdU como molécula trazadora, se observó que el ejercicio no solo incrementó la proliferación de las células progenitoras en la zona subgranular, sino que también aumentó su tasa de supervivencia a medida que se diferenciaban y maduraban (van Praag et al., 1999; Seri et al., 2001; para revisiones de progenitores neurales y progresión del linaje ver Weissman et al., 2001; Seri et al., 2004; Göritz y Frisén, 2012).
Aunque es mucho más difícil estudiar la neurogénesis mediada por el ejercicio en humanos, existe evidencia significativa de que la neurogénesis ocurre en el cerebro humano adulto, especialmente en la circunvolución dentada. De hecho, se ha demostrado que el ejercicio aumenta el tamaño del hipocampo en adultos humanos (Erickson et al., 2011). A través del análisis tisular post mortem de pacientes con cáncer a los que se les administró BrdU, se ha demostrado que las neuronas granuladas maduras se generan continuamente a partir de la zona subgranular, incluso en las etapas posteriores de la vida (Eriksson et al., 1998). Curiosamente, los participantes en este estudio no fueron asignados a condiciones de ejercicio, y como eran pacientes con cáncer cerca de la muerte, es poco probable que participaran en algún régimen de ejercicio. Esto sugiere que el hipocampo tiene la capacidad de generar nuevas neuronas en la edad adulta independientemente del ejercicio. Secciones posteriores de esta revisión, sin embargo, proporcionan evidencia de que el ejercicio acentúa la neurogénesis en humanos y aborda cómo la cantidad de ejercicio modula el grado de neurogénesis.
Mediación BDNF de la Neurogénesis Hipocampal
Teniendo en cuenta estos hallazgos tempranos que establecen una conexión entre el ejercicio y la neurogénesis del hipocampo, los investigadores volvieron a examinar los fundamentos biológicos. Uno de los candidatos más fuertes para cerrar la brecha entre el ejercicio y la neurogénesis es el BDNF, un factor de crecimiento categorizado bajo la familia de las neurotrofinas ampliamente expresado en el cerebro y en todo el resto del sistema nervioso central (Salehi et al., 2003). Investigaciones tempranas sobre esta molécula encontraron que durante el desarrollo en ratones, la expresión de BDNF es baja durante el desarrollo prenatal, pero luego aumenta durante las primeras semanas después de nacer y alcanza su punto máximo durante el cambio de la neurogénesis embrionaria a la adulta (Bath et al., 2012). Esto proporciona una visión clave de su potencial para facilitar la neurogénesis, que luego despertó mucho más interés en la investigación en su conexión con la neurogénesis.
BDNF
En su conjunto, los polipéptidos de la familia de las neurotrofinas son vitales para la regulación de los procesos neurales en la neurogénesis, como la proliferación, diferenciación, maduración y plasticidad. Dentro de esta familia, el BDNF exhibe el mayor grado de expresión en el cerebro, y se sintetiza principalmente allí durante el ejercicio (Reichardt, 2006). El BDNF también puede ingresar al cerebro a través de la difusión libre a través de la barrera hematoencefálica (Pan et al., 1998; Mousavi y Jasmin, 2006). Además, durante el ejercicio, las proteínas y sus derivados metabólicos secretados por los músculos periféricos, como la catepsina B y FnDC5/irisina, también cruzan la barrera hematoencefálica para mediar la expresión del BDNF en el hipocampo y la posterior neurogénesis y mejora de la memoria (Wrann et al., 2013 ; Moon et al., 2016). De hecho, los ratones inyectados con factores de resistencia del músculo esquelético tuvieron niveles elevados de neurogénesis hipocampal y aumento de la memoria espacial (Kobilo et al., 2010).
El BDNF funciona uniéndose al receptor de tropomiosina quinasa B (TrkB), que se expresa en gran medida en las neuronas del hipocampo. Tras la unión, el complejo BDNF-TrkB sirve como un sitio de acoplamiento para numerosas cascadas de señalización, cascadas de fosforilación de proteínas y sistemas de señalización secundarios (Huang y Reichardt, 2003; Nykjaer et al., 2005; Yoshii y Constantina-Paton, 2003; , 2010). A través de estas vías (mostradas en la Figura\(\PageIndex{1}\)), el BDNF puede ejercer un control regulador significativo sobre muchas facetas de la función de una neurona e influir así en cómo funcionan estas neuronas como un todo dentro del hipocampo.
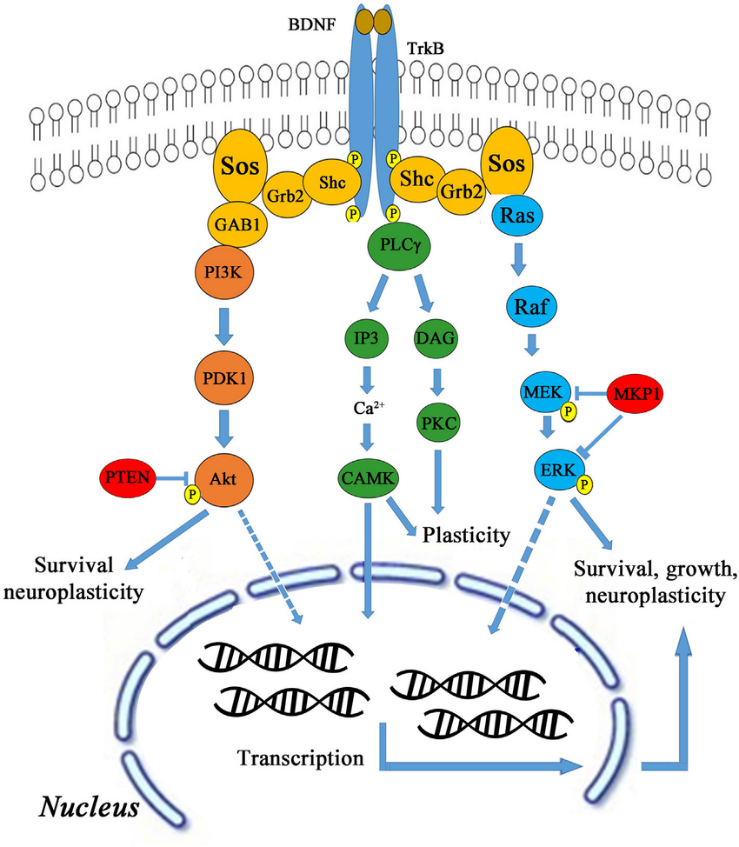
Figura\(\PageIndex{1}\). Vías que activa el BDNF. El factor neurotrófico derivado del cerebro activa TrkB a través de varias vías de señalización posteriores, como AKT, CaMK, Ras/Raf/MEK/ERK que conducen a la supervivencia celular, el crecimiento y la neuroplasticidad. El BDNF activa la estimulación de TrkB a través de la fosfatidilinositol-4,5-bisfosfato 3-quinasa (PI3K) y también activa proteínas como Shc, Grb-2 y Gab-1. El PI3K también se activa mediante la unión al homólogo de Ras enriquecido con trifosfato de glutamina cerebral (Ras-GTP). Imagen de: https://doi.org/10.3389/fneur.2016.00094. Bajo CC por 4.0
Ejercicio y expresión BDNF
Hasta el momento, tanto el ejercicio como el BDNF han demostrado estar asociados con un aumento de la neurogénesis. Investigaciones adicionales han extendido esto para mostrar que el ejercicio en cinta rodante en ratones y el ejercicio aeróbico en humanos aumenta la expresión del BDNF regulando la expresión del gen BDNF en el hipocampo (Kim et al., 2015). Este proceso está mediado en gran medida por sistemas neurotransmisores y neuroendocrinos, con una extensa literatura que apoya a la acetilcolina (ACh) como regulador clave (Knipper et al., 1994).
En ratones a los que se les permitió participar voluntariamente en la rueda, se observó un aumento en los niveles de ARNm del BDNF en la circunvolución dentada después de solo unos días de ejercicio (Neeper et al., 1995). Sorprendentemente, estos niveles se mantuvieron a lo largo de varias semanas de ejercicio y correspondieron a aumentos proporcionales en la expresión de la proteína BDNF (Russo-Neustadt et al., 1999). Sin embargo, cuando las condiciones de ejercicio se complementaron con anticuerpos bloqueantes de TrkB, los ratones tenían capacidades de aprendizaje atenuadas que involucraban al hipocampo. Además, estos ratones también carecían de proteínas específicas de sináptica en el hipocampo, demostrando así que la señalización del BDNF es necesaria para permitir que se manifiesten los beneficios del ejercicio (Vaynman et al., 2004, 2006).
La investigación también ha demostrado que las métricas de calidad general de salud en humanos siguen una relación dosis-dependiente con la duración e intensidad del ejercicio, con los mejores resultados vinculados al ejercicio moderado (Larson et al., 2006). El trabajo adicional ilustra que los ratones muestran mayores mejoras en el aprendizaje basado en la adquisición y retención en tareas dependientes del hipocampo después del ejercicio a largo plazo en lugar de regímenes de ejercicio más cortos (Handschin y Spiegelman, 2008; Parachikova et al., 2008 ; Parachikova et al., 2008 ; Ploeger et al., 2009). Se encontró que en ratones, incluso una sola sesión de ejercicio incrementó los niveles de BDNF. Este efecto, sin embargo, se amplificó luego de un período de ejercicio en ratones que ejercieron regularmente, con una mayor respuesta en los niveles de BDNF en relación con los ratones después de una sola sesión de ejercicio (Johnson et al., 2003; van Praag et al., 2005; Rasmussen et al., 2009). Consistente con estos hallazgos es un metaanálisis de 29 estudios que abarcaron 1,111 participantes humanos que analizaron los niveles de expresión de BDNF en varios paradigmas de ejercicio. Sin embargo, muchos de los estudios solo examinaron el ejercicio moderado, y varios estudios no reportaron nivel de intensidad. Curiosamente, la evidencia considerable de este metaanálisis sugiere que los humanos también experimentan una relación dosis-respuesta en la que cada sesión de ejercicio corresponde a una dosis de expresión incrementada del BDNF. Además, se ha demostrado que el ejercicio regular en cantidades moderadas aumenta la magnitud de la expresión del BDNF después de sesiones individuales de ejercicio (Szuhany et al., 2015).
Sin embargo, no existe una correlación positiva perfecta entre la cantidad e intensidad del ejercicio y los niveles de expresión del BDNF y los beneficios posteriores para la salud. Se ha demostrado que el ejercicio extremo interrumpe una serie de procesos metabólicos y fisiológicos y conduce a un deterioro del rendimiento cognitivo en humanos (Aguiló et al., 2005). Dado que el oxígeno se metaboliza rápidamente durante el esfuerzo físico, las especies reactivas de oxígeno (ROS) se producen naturalmente como subproducto metabólico. Cuando se producen en niveles altos, como durante episodios de ejercicio intenso, las ROS pueden provocar daño oxidativo y aumento de la mortalidad celular tanto en roedores como en humanos (Radak et al., 2016). Los niveles moderados de ejercicio imponen el sistema de defensa antioxidante del cuerpo humano, pero los niveles extremos de ejercicio conducen a la generación de más ROS de los que el sistema antioxidante puede defenderse, permitiendo así su acumulación como estrés oxidativo (Mastaloudis et al., 2001). De hecho, al tratarse con peróxido de hidrógeno, un potente ROS, los cultivos celulares del hipocampo tomados de roedores mostraron una relación inversa entre los niveles de expresión de BDNF y la concentración de peróxido de hidrógeno (Kwon et al., 2013). La producción in vivo de BDNF en función de la producción de ROS, sin embargo, es menos clara y merece un estudio adicional.
No todos los BDNF son iguales
En humanos hay polimorfismos frecuentes en el gen BDNF que se encuentran típicamente en la posición 66 que convierte la valina en metionina. Trabajos previos a principios de la década de 2000 sugirieron que de alguna manera este gen no funcionaba bien en personas con esquizofrenia y que este polimorfismo Met66 estaría vinculado a trastornos del cerebro incluyendo la esquizofrenia.
Cuando los investigadores examinaron los polimorfismos en el gen y la esquizofrenia y el efecto sobre la disfunción hipocampal en un estudio de 641 individuos reportados en Cell 2003 por Egan et al. cohortes de esquizofrenia, hermanos e individuos normales fueron examinados para ver si había una relación. Sin embargo, resultó que este polimorfismo no tuvo diferencia en las habilidades de recuerdo cognitivo en individuos con esquizofrenia pero los individuos normales (es decir, sus hermanos) que no tenían síntomas mostraron una reducción drástica del recuerdo de la memoria con la mutación Met66. Investigaciones posteriores mostraron que este polimorfismo dificulta la liberación del BDNF, afectando por lo tanto la salud neuronal. Entonces, aunque un individuo ejerciera, ¡no hay garantía de que se liberará más BDNF! ¡La efectividad del ejercicio está literalmente en tus genes BDNF!
Licencia
Adaptado de https://www.frontiersin.org/articles...018.00052/full


