11.1: Actividad Electrónica en Reacciones Químicas
- Page ID
- 155303
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
En el primer capítulo de este libro, se discutió el concepto de átomo, como el bloque básico de construcción de todos los objetos materiales. Los átomos, a su vez, están compuestos de piezas de materia aún más pequeñas llamadas partículas. Los electrones, protones y neutrones son los tipos básicos de partículas que se encuentran en los átomos. Cada uno de estos tipos de partículas juega un papel distinto en el comportamiento de un átomo. Si bien la actividad eléctrica implica el movimiento de electrones, la identidad química de un átomo (que determina en gran medida qué tan conductor será el material) está determinada por el número de protones en el núcleo (centro).

Los protones en el núcleo de un átomo son extremadamente difíciles de desalojar, por lo que la identidad química de cualquier átomo es muy estable. Uno de los objetivos de los antiguos alquimistas (convertir el plomo en oro) se vio frustrado por esta estabilidad subatómica. Todos los esfuerzos para alterar esta propiedad de un átomo por medio del calor, la luz o la fricción se encontraron con fallas. Los electrones de un átomo, sin embargo, son mucho más fácilmente desalojados. Como ya hemos visto, la fricción es una forma en la que los electrones pueden transferirse de un átomo a otro (vidrio y seda, cera y lana), así como calor (generando voltaje calentando una unión de metales disímiles, como en el caso de los termopares).
Los electrones pueden hacer mucho más que simplemente moverse alrededor y entre átomos: también pueden servir para unir diferentes átomos entre sí. Este enlace de átomos por electrones se llama enlace químico. Una representación cruda (y simplificada) de tal enlace entre dos átomos podría verse así:
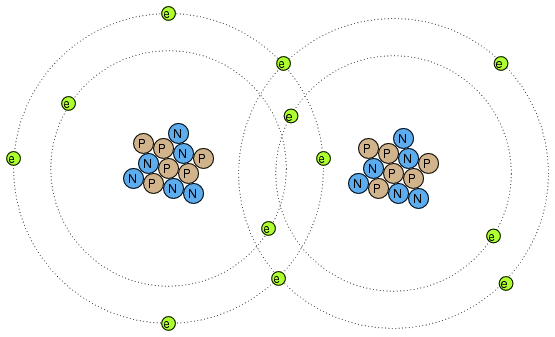
Existen varios tipos de enlaces químicos, siendo el mostrado anteriormente representativo de un enlace covalente, donde los electrones se comparten entre átomos. Debido a que los enlaces químicos se basan en enlaces formados por electrones, estos enlaces son tan fuertes como la inmovilidad de los electrones que los forman. Es decir, los enlaces químicos pueden crearse o romperse por las mismas fuerzas que obligan a los electrones a moverse: calor, luz, fricción, etc.
Cuando los átomos están unidos por enlaces químicos, forman materiales con propiedades únicas conocidas como moléculas. La imagen de doble átomo que se muestra arriba es un ejemplo de una molécula simple formada por dos átomos del mismo tipo. La mayoría de las moléculas son uniones de diferentes tipos de átomos. Incluso las moléculas formadas por átomos del mismo tipo pueden tener propiedades físicas radicalmente diferentes. Tomemos el elemento carbono, por ejemplo: en una forma, el grafito, los átomos de carbono se unen para formar “placas” planas que se deslizan una contra la otra muy fácilmente, dando al grafito sus propiedades lubricantes naturales. En otra forma, el diamante, los mismos átomos de carbono se unen entre sí en una configuración diferente, esta vez en las formas de pirámides entrelazadas, formando un material de dureza superior. En otra forma más, el fullereno, decenas de átomos de carbono forman cada molécula, que parece algo así como un balón de fútbol. Las moléculas de fullereno son muy frágiles y ligeras. El hollín aireado formado por la combustión excesivamente rica de gas acetileno (como en la ignición inicial de un soplete de soldadura/corte de oxiacetileno) contiene muchas moléculas de fullereno.
Cuando los alquimistas lograron cambiar las propiedades de una sustancia por calor, luz, fricción o mezcla con otras sustancias, realmente estaban observando cambios en los tipos de moléculas formadas por átomos que se rompen y forman enlaces con otros átomos. La química es la contraparte moderna de la alquimia y se ocupa principalmente de las propiedades de estos enlaces químicos y las reacciones asociadas con ellos.
Un tipo de enlace químico de particular interés para nuestro estudio de las baterías es el llamado enlace iónico, y difiere del enlace covalente en que un átomo de la molécula posee un exceso de electrones mientras que otro átomo carece de electrones, siendo los enlaces entre ellos resultado de la atracción electrostática entre los dos a diferencia de las cargas.
Cuando los enlaces iónicos se forman a partir de átomos neutros, hay una transferencia de electrones entre los átomos cargados positiva y negativamente. Se dice que un átomo que gana un exceso de electrones se reduce; se dice que un átomo con una deficiencia de electrones está oxidado. Un mnemotécnico para ayudar a recordar las definiciones es OIL RIG (oxidado es menor; se gana reducido). Es importante señalar que las moléculas a menudo contendrán enlaces iónicos y covalentes. El hidróxido de sodio (lejía, NaOH) tiene un enlace iónico entre el átomo de sodio (positivo) y el ion hidroxilo (negativo). El ion hidroxilo tiene un enlace covalente (mostrado como una barra) entre los átomos de hidrógeno y oxígeno:
Na + O—H - El sodio sólo pierde un electrón, por lo que su carga es +1 en el ejemplo anterior. Si un átomo pierde más de un electrón, la carga resultante puede indicarse como +2, +3, +4, etc. o mediante un número romano entre paréntesis que muestre el estado de oxidación, como (I), (II), (IV), etc. Algunos átomos pueden tener múltiples estados de oxidación, y a veces es importante incluir el estado de oxidación en el fórmula molecular para evitar ambigüedades.
La formación de iones y enlaces iónicos a partir de átomos neutros o moléculas (o viceversa) implica la transferencia de electrones. Esa transferencia de electrones puede aprovecharse para generar una corriente eléctrica.Un dispositivo construido para hacer precisamente esto se llama celda voltaica, o celda para abreviar, generalmente consiste en dos electrodos metálicos sumergidos en una mezcla química (llamada electrolito) diseñada para facilitar dicha reacción electroquímica (oxidación/reducción):

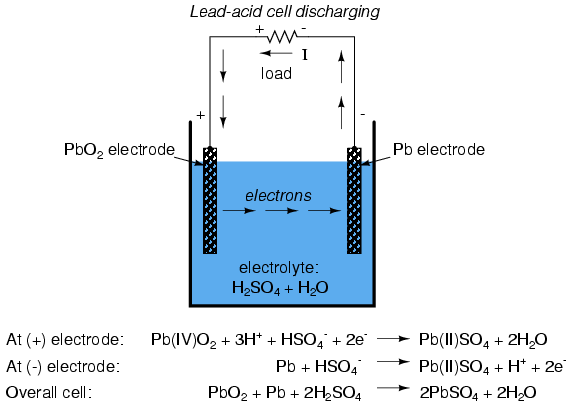
En la celda común de “plomo-ácido” (la clase comúnmente utilizada en automóviles), el electrodo negativo está hecho de plomo (Pb) y el positivo está hecho de dióxido de plomo (IV) (PbO 2), ambas sustancias metálicas. Es importante señalar que el dióxido de plomo es metálico y es un conductor eléctrico, a diferencia de otros óxidos metálicos que suelen ser aislantes. (nota: Tabla siguiente) La solución electrolítica es un ácido sulfúrico diluido (H 2 SO 4 + H 2 O). Si los electrodos de la celda están conectados a un circuito externo, de tal manera que los electrones tienen un lugar para fluir de uno a otro, los átomos de plomo (IV) en el electrodo positivo (PbO 2) ganarán dos electrones cada uno para producir Pb (II) O. Los átomos de oxígeno que son “sobrantes” se combinan con carga positiva iones hidrógeno (H) + para formar agua (H 2 O). Este flujo de electrones al interior del electrodo de dióxido de plomo (PbO 2), le da una carga eléctrica positiva. En consecuencia, los átomos de plomo en el electrodo negativo ceden dos electrones cada uno para producir plomo Pb (II), que se combina con iones sulfato (SO 4 -2) producidos a partir de la disociación de los iones hidrógeno (H +) del ácido sulfúrico (H 2 SO 4) para formar sulfato de plomo (PbSO 4). El flujo de electrones fuera del electrodo de plomo le da una carga eléctrica negativa. Estas reacciones se muestran en forma de diagrama a continuación:
Nota sobre la nomenclatura del óxido de plomo:
Este proceso de la celda que proporciona energía eléctrica para suministrar una carga se denomina descarga ya que está agotando sus reservas químicas internas. Teóricamente, una vez agotado todo el ácido sulfúrico, el resultado serán dos electrodos de sulfato de plomo (PbSO 4) y una solución electrolítica de agua pura (H 2 O), sin dejar más capacidad de unión iónica adicional. En este estado, se dice que la celda está completamente descargada. En una celda de plomo-ácido, el estado de carga se puede determinar mediante un análisis de la fuerza ácida. Esto se logra fácilmente con un dispositivo llamado hidrómetro, que mide la gravedad específica (densidad) del electrolito. El ácido sulfúrico es más denso que el agua, por lo que cuanto mayor es la carga de una celda, mayor es la concentración de ácido y, por lo tanto, una solución electrolítica más densa.
No existe una sola reacción química representativa de todas las células voltáicas, por lo que cualquier discusión detallada de la química tiene una aplicación limitada. Lo importante a entender es que los electrones son motivados hacia y/o desde los electrodos de la célula a través de reacciones iónicas entre las moléculas de electrodo y las moléculas electrolíticas. La reacción se habilita cuando hay un camino externo para la corriente eléctrica y cesa cuando ese camino se rompe.
Siendo que la motivación para que los electrones se muevan a través de una célula es de naturaleza química, la cantidad de voltaje (fuerza electromotriz) generada por cualquier célula será específica de la reacción química particular para ese tipo de célula. Por ejemplo, la celda de plomo-ácido que se acaba de describir tiene un voltaje nominal de 2.04 voltios por celda, basado en una celda completamente “cargada” (concentración de ácido fuerte) en buenas condiciones físicas. Existen otros tipos de celdas con diferentes salidas de voltaje específicas. La celda Edison, por ejemplo, con un electrodo positivo hecho de óxido de níquel, un electrodo negativo hecho de hierro, y una solución electrolítica de hidróxido de potasio (una sustancia cáustica, no ácida) genera una tensión nominal de solo 1.2 voltios, debido a las diferencias específicas en la reacción química con esos electrodos y sustancias electrolíticas.
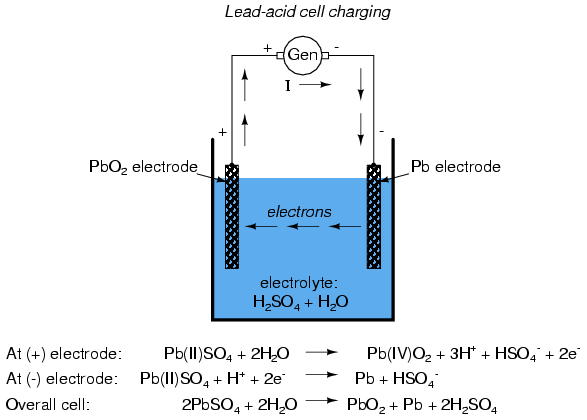
Las reacciones químicas de algunos tipos de células se pueden revertir forzando la corriente eléctrica hacia atrás a través de la celda (en el electrodo negativo y fuera del electrodo positivo). A este proceso se le llama cobro. Cualquier celda (recargable) de este tipo se llama celda secundaria. Una célula cuya química no puede ser revertida por una corriente inversa se llama célula primaria.
Cuando una celda de plomo-ácido es cargada por una fuente de corriente externa, las reacciones químicas experimentadas durante la descarga se invierten:
Revisar
- Los átomos unidos entre sí por electrones se llaman moléculas.
- Los enlaces iónicos son uniones moleculares formadas cuando un átomo deficiente en electrones (un ion positivo) se une con un átomo excesivo de electrones (un ion negativo).
- Las reacciones electroquímicas implican la transferencia de electrones entre átomos. Esta transferencia puede ser aprovechada para formar una corriente eléctrica.
- Una celda es un dispositivo construido para aprovechar tales reacciones químicas para generar corriente eléctrica.
- Se dice que una celda se descarga cuando sus reservas químicas internas se han agotado a través del uso.
- La química de una célula secundaria se puede revertir (recargar) forzando la corriente hacia atrás a través de ella.
- Una celda primaria prácticamente no se puede recargar.
- La carga de la celda de plomo-ácido se puede evaluar con un instrumento llamado hidrómetro, que mide la densidad del líquido electrolítico. Cuanto más denso es el electrolito, más fuerte es la concentración de ácido y mayor estado de carga de la celda.


