3.11: Propiedades Bioquímicas del Agua
- Page ID
- 55739
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
A menudo se le llama el “planeta del agua”, y se le ha dado el apodo de “el mármol azul”. Probablemente solo lo llames “hogar”. Casi tres cuartas partes de nuestro planeta natal está cubierto por el agua, y sin ella, la vida tal como la conocemos no podría existir en la Tierra. El agua, como el carbono, tiene un papel especial en los seres vivos. Es necesario por todas las formas de vida conocidas. Si bien el agua consiste en moléculas simples, cada una de las cuales contiene solo tres átomos, su estructura le otorga propiedades únicas que ayudan a explicar por qué es vital para todos los organismos vivos.

Estructura Química y Propiedades del Agua
Probablemente ya estés familiarizado con muchas de las propiedades del agua. Por ejemplo, sin duda sabes que el agua es insípida, inodora y transparente. En pequeñas cantidades, también es incoloro. Sin embargo, cuando se observa una gran cantidad de agua, como en un lago o en el océano, en realidad es de color azul claro. La tonalidad azul del agua es una propiedad intrínseca y es causada por la absorción selectiva y dispersión de la luz blanca. Estas y otras propiedades del agua dependen de su estructura química.
La transparencia del agua es importante para los organismos que viven en el agua. Debido a que el agua es transparente, la luz del sol puede pasar por ella. La luz solar es necesaria por las plantas acuáticas y otros organismos acuáticos para la fotosíntesis.
Estructura Química del Agua
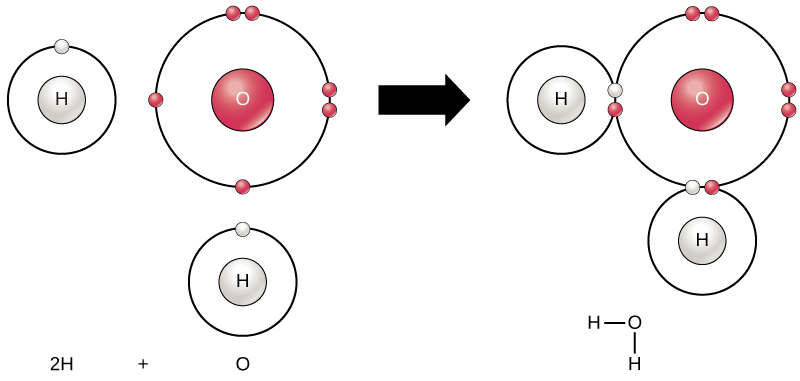
Cada molécula de agua consiste en un átomo de oxígeno y dos átomos de hidrógeno, por lo que tiene la fórmula química H 2 O. La disposición de los átomos en una molécula de agua, mostrada en la Figura\(\PageIndex{2}\), explica muchas de las propiedades químicas del agua. En cada molécula de agua, el núcleo del átomo de oxígeno (con 8 protones cargados positivamente) atrae electrones mucho más fuertemente que los núcleos de hidrógeno (con solo un protón cargado positivamente). Esto da como resultado una carga eléctrica negativa cerca del átomo de oxígeno (debido a la “atracción” de los electrones cargados negativamente hacia el núcleo de oxígeno) y una carga eléctrica positiva cerca de los átomos de hidrógeno. Una diferencia en la carga eléctrica entre diferentes partes de una molécula se llama polaridad. Una molécula polar es una molécula en la que parte de la molécula está cargada positivamente y parte de la molécula está cargada negativamente.
El agua es un buen solvente
El agua se considera un muy buen disolvente en las reacciones bioquímicas. La figura\(\PageIndex{3}\) ilustra cómo el agua disuelve las sales. La sal de mesa (NaCl) consiste en un ion de sodio cargado positivamente y un ion cloruro cargado negativamente. El oxígeno del agua es atraído por el ion Na positivo. Los hidrógenos del agua son atraídos por el ion Cl negativo.

Enlace de hidrógeno
Las cargas eléctricas opuestas se atraen entre sí. Por lo tanto, la parte positiva de una molécula de agua es atraída por las partes negativas de otras moléculas de agua. Debido a esta atracción, se forman enlaces entre los átomos de hidrógeno y oxígeno de las moléculas de agua adyacentes, como se demuestra en la Figura\(\PageIndex{4}\). Este tipo de enlace siempre involucra un átomo de hidrógeno, por lo que se denomina enlace de hidrógeno.
Los enlaces de hidrógeno también se pueden formar dentro de una sola molécula orgánica grande. Por ejemplo, los enlaces de hidrógeno que se forman entre diferentes partes de una molécula de proteína doblan la molécula en una forma distintiva, lo cual es importante para las funciones de la proteína. Los enlaces de hidrógeno también mantienen unidas las dos cadenas de nucleótidos de una molécula de ADN.

Agua húmeda y pegajosa
El agua tiene algunas propiedades inusuales debido a sus enlaces de hidrógeno. Una propiedad es la cohesión, la tendencia de las moléculas de agua a pegarse entre sí. Las fuerzas cohesivas entre las moléculas de agua son responsables del fenómeno conocido como tensión superficial. Las moléculas en la superficie no tienen otras moléculas similares en todos los lados de ellas y consecuentemente, cohere más fuertemente con las directamente asociadas con ellas en la superficie. Por ejemplo, si dejas caer una pequeña cantidad de agua sobre una superficie muy lisa, las moléculas de agua se pegarán y formarán una gotita, en lugar de extenderse sobre la superficie. Lo mismo sucede cuando el agua gotea lentamente de un grifo con fugas. El agua no cae del grifo como moléculas de agua individuales sino como gotitas de agua. La tendencia del agua a pegarse en gotitas también se ilustra por las gotas de rocío en la Figura\(\PageIndex{5}\).

Otra propiedad física importante del agua es la adherencia. En cuanto al agua, la adhesión es la unión de una molécula de agua a otra sustancia, como los lados de las venas de una hoja. Este proceso ocurre porque los enlaces de hidrógeno son especiales en que se rompen y se reforman con gran frecuencia. Esta reorganización constante de los enlaces de hidrógeno permite que un porcentaje de todas las moléculas de una muestra dada se unan a otra sustancia. Esta característica similar al agarre que forman las moléculas de agua provoca la acción capilar, la capacidad de un líquido para fluir contra la gravedad en un espacio estrecho. Un ejemplo de acción capilar es cuando colocas una pajita en un vaso de agua. El agua parece subir por la paja incluso antes de que coloques la boca sobre la pajita. El agua ha creado enlaces de hidrógeno con la superficie de la paja, lo que hace que el agua se adhiera a los lados de la paja. A medida que los enlaces de hidrógeno siguen intercambiando con la superficie de la paja, las moléculas de agua intercambian posiciones y algunas comienzan a ascender a la paja.
La adhesión y la acción capilar son necesarias para la supervivencia de la mayoría de los organismos. Es el mecanismo que se encarga del transporte de agua en las plantas a través de raíces y tallos, y en animales a través de pequeños vasos sanguíneos.
Los enlaces de hidrógeno también explican por qué el punto de ebullición del agua (100°C) es mayor que los puntos de ebullición de sustancias similares sin enlaces de hidrógeno. Debido al punto de ebullición relativamente alto del agua, la mayor parte del agua existe en estado líquido en la Tierra. El agua líquida es necesaria para todos los organismos vivos. Por lo tanto, la disponibilidad de agua líquida permite que la vida sobreviva en gran parte del planeta.
Además, el agua tiene un alto calor específico porque se necesita mucha energía para subir o bajar la temperatura del agua. Como resultado, el agua juega un papel muy importante en la regulación de la temperatura. Dado que las células están compuestas por agua, esta propiedad ayuda a mantener la homeostasis.
La densidad del hielo y el agua
El punto de fusión del agua es 0°C Por debajo de esta temperatura, el agua es un sólido (hielo). A diferencia de la mayoría de las sustancias químicas, el agua en estado sólido tiene una densidad menor que el agua en estado líquido. Esto se debe a que el agua se expande cuando se congela. Nuevamente, el enlace de hidrógeno es la razón. Los enlaces de hidrógeno hacen que las moléculas de agua se alineen de manera menos eficiente en hielo que en agua líquida. Como resultado, las moléculas de agua están más espaciadas en hielo, lo que le da al hielo una densidad menor que el agua líquida. Una sustancia con menor densidad flota sobre una sustancia con mayor densidad. Esto explica por qué el hielo flota en el agua líquida, mientras que muchos otros sólidos se hunden hasta el fondo del agua líquida.
En un gran cuerpo de agua, como un lago o el océano, el agua con mayor densidad siempre se hunde hasta el fondo. El agua es más densa a aproximadamente 4°C. Como resultado, el agua en el fondo de un lago o del océano suele tener una temperatura de aproximadamente 4°C. En climas con inviernos fríos, esta capa de agua de 4°C aísla el fondo de un lago de temperaturas heladas. Los organismos lacustres como los peces pueden sobrevivir al invierno permaneciendo en este agua fría, pero descongelada, en el fondo del lago.
Revisar
- Describir la estructura de una molécula de agua. ¿Qué es la polaridad y por qué es polar el agua?
- ¿Explicar cómo la polaridad interna de la molécula de agua la convierte en un buen solvente?
- Explica cómo los enlaces de hidrógeno hacen que las moléculas de agua líquida se peguen entre sí
- ¿Qué es la acción capilar? Dé un ejemplo.
- ¿Qué propiedad del agua ayuda a mantener la homeostasis y cómo?
Atribuciones
- Planeta Agua por NASA/Robert Simmon y Marit Jentoft-Nilsen, dominio público vía Wikimedia Commons
- Agua por Lumen Learning licencia CC BY 2.0
- Disolver sal por Charles Molnar y Jane Gair, licenciado CC BY 4.0
- Enlace de hidrógeno por Lumen Learning con licencia CC BY 2.0
- Gotas de agua por el Servicio de Pesca y Vida Silvestre de EE.UU., dominio público vía Wikimedia Commons
- Texto adaptado de Biología Humana por CK-12 licenciado CC BY-NC 3.0


