11.4: Avances recientes en terapia génica
- Page ID
- 57202
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Alcanzar el objetivo de terapias génicas efectivas para enfermedades humanas ha sido difícil. Algunos de los problemas que quedan por resolver incluyen:
- cómo evitar una respuesta inmune en el paciente, que puede interferir con la terapia génica de dos maneras:
- El vector provoca inflamación.
- El vector provoca anticuerpos que destruyen el vector cuando se administra de nuevo.
- cómo introducir el gen en células que no se dividen como el hígado, los músculos y las neuronas;
- cómo conseguir que el gen se replique (en células en división) y se exprese indefinidamente pero
- minimizar el riesgo de que se inserte cerca de un protooncogén que pueda activar produciendo un cáncer. (Esto ocurrió en varios niños pequeños tratados con un vector retroviral basado en el virus de la leucemia murina.
- cómo lograr que el gen se exprese según sea necesario; es decir, cómo llevar el gen bajo controles fisiológicos normales para que su producto se produzca donde, cuándo y en las cantidades necesarias.
Virus Adeno-Asociado (AAV) — ¿Una posible solución?
El virus adenoasociado recibe su nombre porque a menudo se encuentra en células que se infectan simultáneamente con adenovirus. No obstante, por sí mismo parece ser inofensivo. A diferencia de adenovirus, AAV
- no estimula la inflamación en el huésped;
- puede ingresar a células que no se dividen;
- se integra con éxito en un solo punto en el genoma de su huésped, en el cromosoma 19 en humanos.
- (Sin embargo, los vectores AAV provocan una fuerte respuesta inmune por lo que solo pueden usarse una vez).
En cuanto al problema de conseguir que el transgén se exprese apropiadamente, eso puede resolverse usando dos vectores AAV simultáneamente:
- uno que porta el gen deseado (por ejemplo, para el factor VIII o la adenosina desaminasa, o en el caso ilustrado aquí, eritropoyetina) en las células del huésped;
- el otro portador de genes para los componentes de los factores de transcripción necesarios para activar ese gen.
Producción regulada de eritropoyetina (EPO)
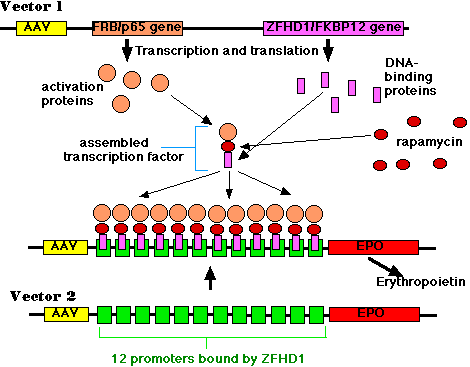
Vector 1
Esta pieza de ADN contenía (entre otras cosas):
- el ADN del virus adenoasociado (AAV)
- un gen que codifica una proteína que contiene dos dominios:
- una porción de la molécula (” p65 “) que se necesita para activar la transcripción génica pero que por sí misma no puede unirse al ADN
- una porción (” FRB “) que se une al fármaco rapamicina.
- un gen que codifica otra proteína con dos dominios:
- una porción de molécula (” ZFHD1 “) que se une específicamente a la secuencia de ADN en el promotor del gen de la eritropoyetina pero que por sí misma no puede activar la transcripción del gen;
- una porción (” FKBP12 “) que también se une a rapamicina.
- promotores (no mostrados) que permiten la expresión continua (transcripción y traducción) de los dos genes. Pero tenga en cuenta que, por sí mismos, los dos productos génicos están inactivos
Vector 2
Esta pieza de ADN contenía (entre otras cosas):
- el ADN del virus adenoasociado (AAV)
- 12 promotores idénticos (cajas verdes) del gen de la eritropoyetina
- el gen de la eritropoyetina (EPO) en sí mismo
El Experimento
Los animales experimentales fueron inyectados (en sus músculos esqueléticos) con muchas copias de ambos vectores. Se eligió músculo esquelético porque las fibras musculares son multinucleadas. Una vez a través de la membrana plasmática, hay muchos núcleos en los que los vectores pueden entrar y por lo tanto muchas oportunidades para integrarse en el ADN del huésped.
Posteriormente se inyectó rapamicina a los animales. Esta pequeña molécula es un inmunosupresor y actualmente se está probando en receptores de trasplante para ayudarlos a evitar el rechazo del trasplante. Se utilizó aquí debido a su capacidad de unirse simultáneamente a los dominios FRB y FKBP12 de los dos productos génicos del vector 1. El trímero resultante es un factor de transcripción activo para el gen de la eritropoyetina.
Los resultados
En ratones
Las inyecciones de los dos vectores no tuvieron —por sí mismas— ningún efecto sobre la producción de EPO ni sobre el número de glóbulos rojos (hematocrito), pero cada vez que a estos animales se les administró una inyección de rapamicina, rápidamente comenzaron a producir EPO (con niveles que aumentaron hasta 100 veces) y aumentó el número de glóbulos rojos (los hematocritos aumentaron de 42% a 60%). La cantidad de EPO producida estuvo directamente relacionada con la cantidad de rapamicina dada. Incluso después de 5 meses, una sola inyección de rapamicina produjo un fuerte aumento en el nivel de EPO en la sangre.
En monos
Los resultados fueron similares a los de los ratones, pero el efecto desapareció después de 4 meses. Entonces aquí hay un sistema donde un gen introducido en un animal puede entonces encenderse dándole al animal una molécula pequeña. (En humanos, la rapamicina se puede administrar por vía oral en forma de píldora.) y puede tener su salida regulada por la cantidad de la molécula pequeña administrada.
Curación de Diabetes Mellitus Insulinodependiente (IDDM) en ratones y ratas
Investigadores en Seúl, Corea informaron en la edición del 23 de noviembre de 2000 de Nature que han utilizado un vector de tipo AAV para curar
- ratones con IDDM heredada (el equivalente animal de diabetes mellitus tipo 1 en humanos)
- ratas con IDDM inducida por destrucción química de sus células beta secretoras de insulina
Ambos grupos de animales fueron inyectados (en su vena porta hepática) con miles de millones de copias de un vector complejo que contenía:
- AAV
- el ADN complementario (ADNc) que codifica una versión sintética de insulina
- un promotor que es activo solo en las células hepáticas y se enciende por la presencia de glucosa
- el ADN que codifica una secuencia señal (para que la insulina pueda ser secretada)
- un potenciador para elevar la expresión de este gen artificial
Los resultados:
Ambos grupos de animales obtuvieron control sobre su nivel de azúcar en la sangre y mantuvieron este control por más de 8 meses. Cuando se les administró glucosa, procedieron a sintetizar la insulina sintética que luego volvió a bajar su glucosa en sangre a niveles normales.
Curación de la hemofilia B en ratones
Investigadores del Instituto Salk informaron (en la edición del 30 de marzo de 1999 de las Actas de la Academia Nacional de Ciencias) trabajar con ratones
- cuyos genes para el factor IX de coagulación habían sido “noqueados” y
- así fueron sometidos a sangrado incontrolado como pacientes humanos con hemofilia B.
Estos ratones fueron inyectados (también en la vena porta hepática) con ADN que contenía
- AAV
- ADNc para el factor IX (el gen del perro)
- secuencias promotoras y potenciadoras específicas del hígado
Los ratones procedieron a elaborar el factor IX y ya no fueron susceptibles a sangrado incontrolado.
En trabajos posteriores, la inyección de células madre embrionarias con genes funcionales del factor IX en el hígado de ratones sin los genes los curó.
Tratamiento de ELA
La ELA (esclerosis lateral miotrófica) es una enfermedad humana en la que las neuronas motoras degeneran. (A menudo se le llama “enfermedad de Lou Gehrig” por el beisbolista que murió a causa de ella.)
Una enfermedad similar se puede crear en ratones transgénicos portadores de genes humanos mutantes (para superóxido dismutasa) asociados con ELA.
Investigadores del Instituto Salk han ralentizado la progresión de la enfermedad en estos ratones inyectando a sus músculos esqueléticos un vector AAV que contiene el gen del factor de crecimiento similar a la insulina 1 (IGF-1). El vector
- invadió las células musculares
- se trasladó a las neuronas motoras unidas a ellas y
- a través de sus axones hasta los cuerpos celulares
Los resultados:
La destrucción de las neuronas motoras se redujo, y los ratones vivieron más tiempo de lo que de otra manera tendrían.
El panorama
Es un gran salto de ratones a humanos, pero estos resultados indican que el principio de la terapia génica para los trastornos de un solo gen es válido.
Y algunos ensayos tempranos en humanos parecen prometedores.
- Una inyección intravenosa de un vector AAV que contiene el ADNc del factor IX ha producido niveles funcionales de factor IX en varios hombres con hemofilia B.
- El 18 de agosto de 2003, médicos de Nueva York inyectaron 3.5 x 10 9 copias de un vector AAV portador de un gen para la síntesis de GABA en el cerebro de un paciente con enfermedad de Parkinson. Fue el primero de un ensayo clínico de fase I de este procedimiento. Para 2007, varios pacientes más de Parkinson habían sido tratados con estas inyecciones sin efectos secundarios nocivos y alguna mejoría en sus síntomas.
- Varios pacientes con una falta heredada de un gen funcional necesario para sintetizar 11-cis-retinal —y así destinados a ser ciegos— han tenido un nivel útil de visión temporalmente restaurado en un ojo inyectado con un vector AAV que contiene el gen (el otro ojo fue el testigo no tratado). Probablemente el hecho de que
- el vector se inyectó directamente en el ojo y así no se diluyó en todo el cuerpo como sería una inyección intravenosa;
- las células retinianas raramente se dividen por lo que el vector no se perdería. (El vector utilizado tenía los genes necesarios para la integración en el ADN de la célula hospedadora removidos por lo que no se podía duplicar en la fase S y, en las células en división, eventualmente desaparecería).
- el interior del ojo es un sitio inmunológicamente privilegiado
- Varios niños que padecen inmunodeficiencia combinada grave ligada al cromosoma X han sido restaurados después de la terapia génica retroviral.
- Algunos pacientes con hemofilia A han mostrado una modesta mejoría al inyectarse con sus propias células que antes habían sido cosechadas y transformadas in vitro con un plásmido que contenía el gen del factor VIII.
- Varios agentes de terapia génica —utilizando vectores adenovirales— se encuentran en ensayos clínicos y han demostrado cierta promesa.
Entre estos:
- un adenovirus recombinante que codifica p53, una proteína supresora de tumores que falta en muchos cánceres
- un adenovirus recombinante que destruye las células que carecen de la proteína p53 (como muchas células cancerosas)
Las personas con el raro trastorno por deficiencia de lipoproteína lipasa son incapaces de procesar los glóbulos (quilomicrones) de grasa y proteína que aparecen en la sangre después de una comida que contiene grasa porque carecen de copias funcionales del gen que codifica la lipoproteína lipasa. La inyección intramuscular de un vector AAV que contiene el gen funcional proporciona una mejora suficiente, con aparente seguridad, que en octubre de 2012, este agente (Glybera®) recibió la aprobación para su uso en la Unión Europea. Es la primera terapia génica en recibir dicha aprobación.


