11.7: Polimorfismos de longitud de fragmentos de restricción
- Page ID
- 57174
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Las enzimas de restricción cortan el ADN en puntos precisos produciendo una colección de fragmentos de ADN de longitud definida con precisión. Estos se pueden separar por electroforesis, con los fragmentos más pequeños migrando más lejos que los fragmentos más grandes. Uno o más de los fragmentos se pueden visualizar con una “sonda”, una molécula de ADN monocatenario que es complementaria a una serie de nucleótidos en uno o más de los fragmentos de restricción y es radiactiva (o fluorescente). Si las sondas encuentran una secuencia complementaria de nucleótidos en una muestra de prueba de ADN, se unen a ella mediante el emparejamiento de bases Watson-Crick y así la identifican. Los polimorfismos son diferencias hereditarias que se encuentran entre los individuos de una población.
Los polimorfismos de longitud de fragmentos de restricción (RFLP) han proporcionado información valiosa en muchas áreas de la biología, incluida la detección de ADN humano para detectar la presencia de genes potencialmente deletéreos (“Caso 1") y proporcionar evidencia para establecer la inocencia de, o una probabilidad de culpabilidad de, un sospechoso de delito por ADN” huella digital” (“Caso 3").
Caso 1: Tamizaje para el gen falciforme
La enfermedad falciforme es un trastorno genético en el que ambos genes en el paciente codifican el aminoácido valina (Val) en la sexta posición de la cadena beta (beta S) de la molécula de hemoglobina. Las cadenas beta “normales” (beta A) tienen ácido glutámico en esta posición. La única diferencia entre los dos genes es la sustitución de una T por una A en la posición media del codón 6. Esto convierte un codón GAG (para Glu) en un codón GTG para Val y suprime una secuencia (CTGAGG, que abarca los codones 5, 6 y 7) reconocida y cortada por una de las enzimas de restricción.


Cuando el gen normal (beta A) se digiere con la enzima y los fragmentos se separan por electroforesis, la sonda se une a un fragmento corto (entre las flechas rojas). Sin embargo, la enzima no puede cortar el gen falciforme en este sitio, por lo que la sonda se une a un fragmento mucho más grande (entre las flechas azules).
La figura\(\PageIndex{1}\) muestra el pedigrí de una familia cuyo único hijo tiene la enfermedad de células falciformes. Tanto su padre como su madre eran heterocigotos (caja semillenada y círculo respectivamente) como tenían que serlo para producir un niño afligido (caja sólida). Los patrones de electroforesis para cada miembro de la familia se colocan directamente debajo de ellos. Obsérvese que los dos niños homocigotos (1 y 3) tienen sólo una sola banda, pero estos son más intensos porque hay el doble de ADN en ellos. En este ejemplo, un cambio de un solo nucleótido produjo el RFLP. Esta es una causa muy común de RFLP y ahora tales polimorfismos a menudo se denominan polimorfismos de un solo nucleótido o SNP. (Sin embargo, no todas las RFLP surgen de los SNP.
Al probar el ADN de los futuros padres, se puede determinar su genotipo y se pueden determinar sus probabilidades de producir un hijo afligido. En el caso de la enfermedad falciforme, si ambos padres son heterocigotos para los genes, existe una probabilidad de 1 en 4 de que produzcan un hijo con la enfermedad. La amniocentesis y el muestreo de vellosidades coriónicas permiten aplicar las mismas técnicas al ADN de un feto temprano en el embarazo. Los padres pueden aprender si el niño por nacer estará libre de la enfermedad o no. Pueden optar por abortar en lugar de traer al mundo a un niño afligido.
Tres problemas:
- Las mutaciones que causan la mayoría de las enfermedades genéticas humanas son más variadas que la mutación única asociada con la enfermedad de células falciformes. Más de mil mutaciones diferentes en el gen de la fibrosis quística pueden causar la enfermedad. Una sonda para uno probablemente no podrá identificar un segundo. Se puede utilizar una mezcla de sondas, una para cada una de las mutaciones más comunes. Pero queda el problema de los “falsos negativos”: personas a las que se les dice falsamente que no portan un gen mutante.
- Hay muchas enfermedades que resultan de varios genes mutantes que trabajan juntos para producir el fenotipo de la enfermedad.
- Todavía hay enfermedades genéticas para las que aún no se ha descubierto ningún gen. Hasta que el gen pueda ser localizado, clonado y secuenciado, no se puede hacer ninguna sonda para detectarlo directamente. Sin embargo, a veces es posible encontrar un “marcador” genético que pueda servir como sustituto del gen mismo. Veamos cómo.
Caso 2: Cribado para un “marcador” RFLP
Si un RFLP en particular generalmente se asocia con una enfermedad genética en particular, entonces la presencia o ausencia de ese RFLP puede usarse para asesorar a las personas sobre su riesgo de desarrollar o transmitir la enfermedad. El supuesto es que el gen que realmente les interesa se localiza tan cerca del RFLP que la presencia del RFLP puede servir como sustituto del gen de la enfermedad en sí. Pero la gente que quiere hacerse la prueba no puede simplemente entrar fuera de la calle. Debido al cruce, un RFLP particular podría estar asociado con el gen mutante en algunas personas, con su alelo saludable en otras. Por lo tanto, es esencial examinar no sólo al paciente sino a tantos miembros de la familia del paciente como sea posible.
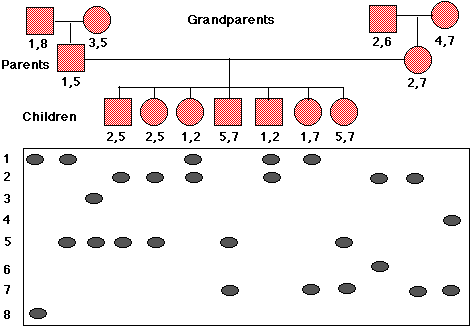
Las sondas más útiles para dicho análisis se unen a una secuencia única de ADN; es decir, una secuencia que ocurre en un solo lugar del genoma. A menudo este ADN es de función desconocida, si la hay. Esto en realidad puede ser útil ya que este ADN ha sido más libre de mutar sin dañar al dueño. La sonda hibridará (se unirá a) diferentes longitudes de ADN digerido en diferentes personas dependiendo de dónde se encuentren los sitios de corte enzimático que cada persona haya heredado. Así, una gran variedad de alelos (polimorfismos) pueden estar presentes en la población. Algunas personas serán homocigóticas y revelarán una sola banda; otras (por ejemplo, todos los miembros de la familia que se muestran a continuación) serán heterocigotos con cada alelo produciendo su banda.
El pedigrí en la Figura\(\PageIndex{2}\) muestra la herencia de un marcador RFLP a través de tres generaciones en una sola familia. Un total de 8 alelos (numerados a la izquierda de las manchas) están presentes en la familia. Los RFLP de cada miembro de la familia se colocan directamente debajo de su símbolo (cuadrados) o su (círculos) y números RFLP.
Si, por ejemplo, todos los que heredaron RFLP 2 también tienen cierto trastorno hereditario, y nadie que carezca de RFLP 2 tiene el trastorno, deducimos que el gen para la enfermedad está estrechamente vinculado a este RFLP. Si los padres deciden tener otro hijo, las pruebas prenatales podrían revelar si ese niño era apto para contraer la enfermedad. Pero tenga en cuenta que el cruce durante la formación del gameto podría haber movido el RFLP al alelo sano. Entonces, cuanto mayor sea la distancia entre el RFLP y el locus génico, menor será la probabilidad de un diagnóstico preciso.
Caso 3: “tipificación” de ADN
Cada célula humana contiene 6 x 10 9 pares de bases de ADN. Parte de esto representa genes que codifican proteínas (por ejemplo, para la cadena beta de la hemoglobina) que son idénticos en una gran proporción de personas. Pero largos tramos de ADN no codifican para nada y son libres de mutar extensamente. Parece seguro que si pudiéramos leer toda la secuencia de ADN en cada humano, nunca encontraríamos dos que fueran idénticas (a menos que las muestras fueran de hermanos idénticos; es decir, derivadas de un solo cigoto).
Entonces el ADN de cada persona es tan único como una huella digital. Esta verdad no ha escapado a las profesiones policiales y jurídicas. El análisis del ADN, llamado tipificación del ADN, es ampliamente utilizado para identificar a violadores y otros delincuentes, determinar la paternidad; es decir, quién es realmente el padre del niño, determinar si un inmigrante esperanzado es, como él o ella afirma, realmente un pariente cercano de residentes ya establecidos.
La figura\(\PageIndex{3}\) muestra los resultados de las pruebas en un caso de violación. Se utilizaron dos sondas: una revelando las bandas en la parte superior y la otra en la parte inferior.
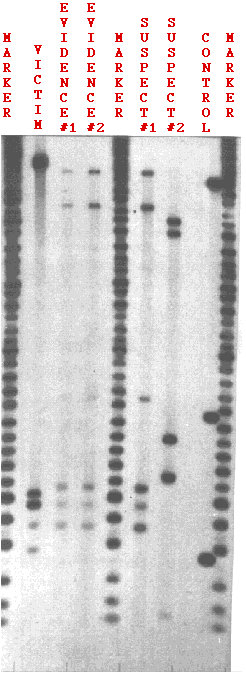 3
3El ADN se probó de
- semen extraído de la vagina de la víctima de violación (EVIDENCIA #2);
- una mancha de semen dejada en la ropa de la víctima (EVIDENCIA #1);
- el ADN de la propia víctima (VÍCTIMA) para asegurarse de que el ADN no provenía de sus células;
- ADN de dos sospechosos (sospechoso #1, sospechoso #2);
- un conjunto de fragmentos de ADN de longitud conocida y decreciente (MARKER). Proporcionan una regla incorporada para medir la distancia exacta que recorre cada fragmento.
- las células de una persona previamente probada para asegurarse de que las sondas están funcionando correctamente (CONTROL).
Una de las bases de esta prueba, el sospechoso #2 puede descartarse claramente. Ninguna de sus bandas coincide con las bandas que se encuentran en el semen.
¿Es culpable el sospechoso #1?
Nunca podemos estar seguros. Lo mejor que podemos hacer es estimar la probabilidad de que otra persona, escogida al azar, pueda proporcionar la misma huella de ADN. Como estimación conservadora, un alelo dado (banda) podría encontrarse en 25% de las personas evaluadas. La probabilidad de una coincidencia aleatoria de dos alelos es (0.25) 2 o 1 en 16. La probabilidad de que 6 alelos coincidan, como en este caso, es (0.25) 6 o 1 en 4096. No obstante, el sospechoso no fue elegido al azar, por lo que puede sentir que la evidencia de culpabilidad es fuerte.
Cuantas más sondas uses, más confianza podrás estar de que has conseguido al hombre adecuado. Si, por ejemplo, un conjunto de sondas reveló 14 bandas en el ADN de un sospechoso idénticas a las de la muestra de semen, la probabilidad de que tengas al hombre equivocado cae a menos de 1 en 268 millones (0.25) 14 = 1/268,435.456, lo que es casi tan grande como toda la población, machos y hembras, en Estados Unidos.
A partir de 1999, los organismos encargados de hacer cumplir la ley tanto en Gran Bretaña como en Estados Unidos comenzaron a cambiar a una nueva versión del análisis RFLP utilizando secuencias más cortas llamadas STRs (” Short Tandem Repeats “). Los STRs son secuencias repetidas de unos pocos (usualmente cuatro) nucleótidos, por ejemplo, TCATTCATTCATTCAT. A menudo ocurren en las partes no traducidas de genes conocidos (cuya secuencia puede usarse para los cebadores de PCR). El número exacto de repeticiones (6, 7, 8, 9, etc.) varía en diferentes personas (y, a menudo, en el gen de cada cromosoma; es decir, las personas suelen ser heterocigóticas para el marcador).
Cuando se examinan 13 loci STR —dispersos sobre diferentes cromosomas—, la probabilidad de que dos personas elegidas al azar tengan el mismo patrón es menor de 1 en 1 billón. La Oficina Federal de Investigaciones (FBI) de Estados Unidos quiere aumentar el número de loci examinados a 20 eliminando aún más la posibilidad de falsos positivos.


