14.4: El Organizador
- Page ID
- 57026
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
En el desarrollo embrionario de un cigoto, gradientes de ARNm y proteínas, depositados en el óvulo por la madre a medida que lo formaba, dan lugar a células de diversos destinos a pesar de sus genomas idénticos. Pero, ¿el embrión está completamente modelado en el óvulo fertilizado? Es difícil imaginar que los gradientes relativamente simples en el óvulo puedan explicar toda la compleja migración y diferenciación de las células durante el desarrollo embrionario. Y, de hecho, la respuesta es no. Sin embargo, una vez que estos gradientes han enviado ciertas células a lo largo de una ruta particular de expresión génica, se establece la etapa para que esas células comiencen a influir en las células cercanas para diversificarse cada vez más.
En otras palabras, las señales célula-intrínsecas (establecidas entre un núcleo y el entorno citoplásmico particular en el que la escisión lo ha colocado) sientan las bases para que las interacciones célula-célula guíen aún más a las células del embrión para que asuman su posición adecuada en el embrión y para diferenciarse en su forma y función final especializada.
Las interacciones célula-célula podrían, y probablemente lo hacen, ocurrir de varias maneras:
- difusión de una molécula de señalización fuera de una célula y hacia otras células en las proximidades;
- difusión de una molécula de señalización de una célula a una célula adyacente que luego secreta la misma molécula para difundirse a la siguiente célula y así sucesivamente (un mecanismo de “relé celular”);
- extensión de proyecciones desde la membrana plasmática de una célula hasta que hagan contacto directo con células cercanas. Esto permite que las proteínas incrustadas en la membrana plasmática sirvan como moléculas de señalización.
El organizador Spemann
En 1924, la estudiante de doctorado Hilde Mangold que trabajaba en el laboratorio del embriólogo alemán Hans Spemann realizó un experimento que demostró que el patrón de desarrollo de las células está influenciado por las actividades de otras células y estimuló una búsqueda, que continúa hasta el día de hoy, para el señales en el trabajo. Spemann y Mangold sabían que las células que se desarrollan en la región de la media luna gris migran al embrión durante la gastrulación y forman la notocorda (la futura columna vertebral; hecha de mesodermo). Cortó un trozo de tejido de la región de media luna gris de un tritón gastrula y lo trasplantó al lado ventral de una segunda gastrula de tritón. Para facilitar el seguimiento del destino del trasplante, utilizó el embrión de una variedad de tritón como donante y una segunda variedad como receptora.
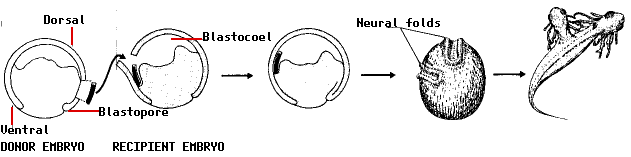
Los resultados notables:
- el tejido trasplantado se desarrolló en una segunda notocorda
- pliegues neurales desarrollados por encima de la notocorda extra
- estos pasaron a formar un segundo sistema nervioso central (porciones del cerebro y la médula espinal) y eventualmente
- un renacuajo de dos cabezas.
El hallazgo más notable de todos fue que los pliegues neurales se construyeron a partir de células receptoras, no de células donantes. En otras palabras, el trasplante había alterado el destino de las células suprayacentes (que normalmente habrían terminado formando piel [epidermis] en el costado del animal) de modo que ¡produjeron una segunda cabeza en su lugar!
Spemann y Mangold utilizaron el término inducción para la capacidad de un grupo de células para influir en el destino de otro. Y debido al notable poder inductivo de las células de media luna gris, llamaron a esta región la organizadora. Desde entonces, se han realizado búsquedas vigorosas para identificar las moléculas liberadas por el organizador que inducen a las células suprayacentes a convertirse en tejido nervioso. Un candidato tras otro ha sido presentado y luego encontrado que no se hace responsable. Parte del problema ha sido que no hasta hace poco ha quedado claro que el organizador NO induce al sistema nervioso central sino que evita que las señales que se originan en el lado ventral de la blástula induzcan allí la piel (epidermis).
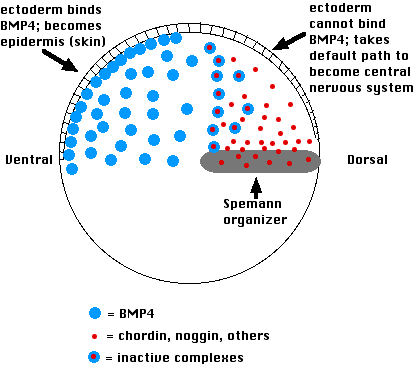
Así es como funciona:
- Las células en el lado ventral de la blástula secretan una variedad de proteínas como b one m orfogenética p roteína-4 (BMP-4)
- Estos inducen al ectodermo anterior a convertirse en epidermis.
- Si se bloquea su acción, se permite que las células ectodérmicas sigan su vía predeterminada, que es convertirse en tejido nervioso del cerebro y la médula espinal.
- El organizador Spemann bloquea la acción de BMP-4 mediante la secreción de moléculas de las proteínas cordina y nogina
- Ambos se unen físicamente a moléculas BMP-4 en el espacio extracelular y así evitan que BMP-4 se una a receptores en la superficie de las células ectodermo suprayacentes.
- Esto permite que las células ectodérmicas sigan su camino intrínseco para formar pliegues neurales y, eventualmente, el cerebro y la médula espinal.
En el experimento Spemann/Mangold, el trasplante de un organizador al lado ventral proporcionó una segunda fuente de cordina. Esto bloqueó la unión de BMP-4 al ectodermo suprayacente y así cambió el destino de esas células a formar un segundo sistema nervioso central en lugar de piel.
¿Qué Organiza el Organizador?
La síntesis de proteínas por las células del organizador requiere la transcripción de los genes relevantes (por ejemplo, cordina). La expresión de genes organizadores depende primero de los factores de transcripción Wnt. Sus ARN mensajeros fueron depositados por la madre en el polo vegetal del huevo. Después de la fertilización y formación de la media luna gris, migraron a la región de la media luna gris (destinada a convertirse en el organizador) donde fueron traducidas a proteína Wnt.
Su acumulación en el lado dorsal del embrión desata la actividad de Nodal, miembro de la familia del Factor de Crecimiento Transformador beta (TGF-β). Nodal induce estas células dorsales a comenzar a expresar las proteínas del organizador de Spemann.
Un organizador de cola
Una de las características distintivas de los vertebrados es su cola, que se extiende detrás del ano. Investigadores franceses han informado (en la edición del 24 de julio de 2003 de Nature) su descubrimiento de un “organizador” de la cola, es decir, un racimo de células en el embrión que induce a las células cercanas a contribuir a la formación de la cola. Trabajaron con el pez cebra, Danio rerio (que también tiene un organizador principal como el de los tritones). Eliminaron pequeños grupos de células de la parte ventral de la blástula (una región aproximadamente opuesta donde se forma el organizador tipo Spemann) y lo trasplantaron a una región del embrión huésped que normalmente formaría flanco. El resultado: una segunda cola.
Mediante una etiqueta fluorescente, pudieron demostrar que la cola extra estaba hecha no solo de descendientes de las células trasplantadas sino también de células hospedadoras que normalmente habrían hecho flanco. Tres proteínas fueron esenciales:
- una proteína Wnt (establece el eje antero-posterior en todos los bilaterianos)
- BMP (establece el eje dorsal-ventral en todos los bilaterianos)
- Nodal (establece el eje izquierda-derecha en todos los bilaterianos)
Patronaje del sistema nervioso central en Drosophila
Notablemente, resulta que proteínas similares en estructura a las proteínas morfogenéticas óseas y también a la cordina se encuentran en Drosophila. El papel de BMP-4 es tomado por una proteína relacionada codificada por el gen decapentapléjico (dpp) y el papel de la cordina es tomado por una proteína relacionada llamada SOG codificada por el gen llamado gastrulación corta.
De hecho, ¡estas proteínas y sus ARNm son completamente intercambiables! Una inyección de los ARNm para BMP-4 o cordina en el blastodermo del embrión de Drosophila puede reemplazar la función de DPP y SOG respectivamente, y a la inversa, las inyecciones de ARNm para DPP o SOG en el embrión de Xenopus imita las funciones de BMP-4 y cordina respectivamente.
| Xenopus | bloqueado por chordin | |
|---|---|---|
| y también por noggin | ||
| Drosophila | Decapentapléjico (DPP) | bloqueado por gastrulación corta (SOG) |
| y también por un homólogo noggin? |
Cuerdas nerviosas dorsales vs ventrales
Aunque sus acciones son similares, la distribución de estas proteínas en Drosophila difiere de la de Xenopus (así como en mamíferos y otros vertebrados). En Drosophila, la DPP se produce en la región dorsal del embrión y el SOG se produce en la región ventral.
Sin embargo, sus acciones sobre las células suprayacentes son las mismas que en Xenopus; es decir, la proteína SOG impide que la proteína DPP bloquee la formación del sistema nervioso central. El resultado en Drosophila es que su sistema nervioso central se forma en el lado ventral del embrión, ¡no en el dorsal! Y, tal vez recuerdes que uno de los rasgos distintivos de todos los artrópodos (insectos, crustáceos, arácnidos) así como de muchos otros invertebrados, como los gusanos anélidos, es un cordón nervioso ventral. Los cordados, incluidos todos los vertebrados, tienen una médula nerviosa dorsal (espinal).
¡Estamos a mitad de camino!
El desarrollo de Xenopus (y probablemente el de los animales en general) pasa por tres fases bastante diferentes (aunque a menudo superpuestas):
- estableciendo los ejes principales (dorsal-ventral; anterior-posterior; izquierda-derecha). Esto se hace por gradientes de ARNm y proteínas codificadas por los genes de la madre y colocadas en el óvulo por ella.
- establecer las partes principales del cuerpo, tales como
- la notocorda y el sistema nervioso central en vertebrados (discutidos aquí y también descritos en FRO.g Embriología)
- y los segmentos en Drosophila
- rellenando los detalles; es decir, construir los diversos órganos del animal. (Nuestros ejemplos incluirán las alas, piernas y ojos de Drosophila.)


