15.4B: unión anticuerpo-antígeno
- Page ID
- 56831
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
\( \newcommand{\id}{\mathrm{id}}\) \( \newcommand{\Span}{\mathrm{span}}\)
( \newcommand{\kernel}{\mathrm{null}\,}\) \( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\) \( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\) \( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\id}{\mathrm{id}}\)
\( \newcommand{\Span}{\mathrm{span}}\)
\( \newcommand{\kernel}{\mathrm{null}\,}\)
\( \newcommand{\range}{\mathrm{range}\,}\)
\( \newcommand{\RealPart}{\mathrm{Re}}\)
\( \newcommand{\ImaginaryPart}{\mathrm{Im}}\)
\( \newcommand{\Argument}{\mathrm{Arg}}\)
\( \newcommand{\norm}[1]{\| #1 \|}\)
\( \newcommand{\inner}[2]{\langle #1, #2 \rangle}\)
\( \newcommand{\Span}{\mathrm{span}}\) \( \newcommand{\AA}{\unicode[.8,0]{x212B}}\)
\( \newcommand{\vectorA}[1]{\vec{#1}} % arrow\)
\( \newcommand{\vectorAt}[1]{\vec{\text{#1}}} % arrow\)
\( \newcommand{\vectorB}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vectorC}[1]{\textbf{#1}} \)
\( \newcommand{\vectorD}[1]{\overrightarrow{#1}} \)
\( \newcommand{\vectorDt}[1]{\overrightarrow{\text{#1}}} \)
\( \newcommand{\vectE}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash{\mathbf {#1}}}} \)
\( \newcommand{\vecs}[1]{\overset { \scriptstyle \rightharpoonup} {\mathbf{#1}} } \)
\( \newcommand{\vecd}[1]{\overset{-\!-\!\rightharpoonup}{\vphantom{a}\smash {#1}}} \)
Los anticuerpos son proteínas sintetizadas y secretadas por las células B que se unen a antígenos. La mayoría de los antígenos son macromoléculas: proteínas, polisacáridos, incluso ADN y ARN. La interacción se produce por fuerzas no covalentes (como la que existe entre las enzimas y su sustrato) entre el sitio de combinación de antígeno en el anticuerpo y una porción del antígeno llamada determinante antigénico o epítopo.

Estas fotos muestran un tipo de interacción —la precipitación— entre anticuerpos y antígeno.
- El tubo contiene anticuerpos contra el polisacárido neumocócico Tipo III aislado de la cápsula que rodea a la bacteria.
- Se agrega una solución del polisacárido.
- La formación de complejos insolubles antígeno-anticuerpo se revela por la aparición casi instantánea de turbidez.
- Después de una hora, los complejos se sedimentan como precipitado. Si la proporción de antígeno a anticuerpo en la mezcla se selecciona adecuadamente, el fluido por encima del precipitado estará desprovisto de ambos.
En el cuerpo humano, esta unión puede literalmente salvar vidas. La cápsula que rodea a los neumococos los protege de la fagocitosis. Los neumococos que no logran hacer una cápsula —formas “R ”— no causan enfermedad. Si los anticuerpos apropiados están presentes en el cuerpo, se combinan con la cápsula. Recubiertos con proteína en lugar de polisacárido, los neumococos ahora son fáciles de ingerir.

Estas fotomicrografías muestran fagocitosis de neumococos recubiertos de anticuerpos.
- Izquierda: Un neutrófilo extiende un pseudopodo hacia dos neumococos.
- Centro: estas bacterias han sido engullidas (flechas), y el neutrófilo comienza a engullir cuatro neumococos más en la parte superior derecha.
- Derecha: Se han escapado dos neumococos.
En los días previos a los antibióticos, el inicio de la producción de anticuerpos por parte del sistema inmune del paciente marcó el punto de inflexión en la progresión de la enfermedad.
El sitio de combinación de antígenos

La fig. 15.4.2.3 muestra la estructura primaria de un anticuerpo IgG. Los diferentes anticuerpos IgG difieren más marcadamente en las llamadas regiones hipervariables (mostradas en rojo):
- tres en la cadena pesada
- tres en la cadena ligera
En la estructura tridimensional (terciaria) de la molécula, las 6 regiones hipervariables se acercan entre sí y conforman el sitio de combinación de antígeno. Por esta razón, las regiones hipervariables también se denominan regiones determinantes de complementariedad (CDR).
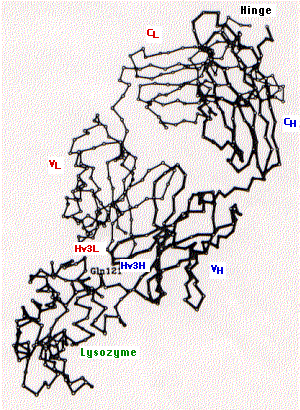

La fig. 15.4.2.4 muestra la estructura terciaria de un brazo de un anticuerpo específico para la lisozima encontrada en clara de huevo de gallina (superior derecha) unida a lisozima (inferior izquierda).
En el diagrama se indican los siguientes:
- región constante de la cadena ligera (C L) y la primera región constante de la cadena pesada (C H)
- regiones variables de las cadenas pesada (V H) y ligera (V L)
- la tercera región hipervariable de las cadenas pesada (Hv3H) y ligera (Hv3L). La importancia del par de terceras regiones hipervariables o determinantes de complementariedad en la unión al epítopo es típica tanto de anticuerpos como de receptores de células T para antígeno. Esto tiene sentido ya que las oportunidades de diversidad genética en esos sitios son mucho mayores que para la primera y segunda CDR.
- Gln121 es una glutamina que es una característica dominante del epítopo en la lisozima
La fig. 15.4.2.5 es un modelo de relleno de espacio del mismo anticuerpo con la cadena ligera en amarillo, la cadena pesada en azul. La vista mira hacia abajo sobre la superficie de unión al epítopo (izquierda) y el epítopo en la lisozima (derecha). En el complejo antígeno-anticuerpo, las dos superficies encajan perfectamente juntas. Los 17 residuos de aminoácidos que contactan con la lisozima en el complejo antígeno-anticuerpo están numerados (1—7 en la cadena L, 8—17 en la cadena H. También se numeran los 16 residuos de aminoácidos de la lisozima que contactan con el anticuerpo; es decir, que conforman su epítopo. El número 14 es Gln-121. La complementariedad del sitio de unión al antígeno y el epítopo, sus formas respectivas y las oportunidades para múltiples interacciones no covalentes determinan la fuerza con la que se unen los dos. La fuerza de la unión de un anticuerpo a su antígeno se llama su afinidad.


